A randomized, controlled double-blind study comparing the efficacy and safety of dose-ranging voclosporin with placebo in achieving remission in patients with active lupus nephritis
Rovin BH, et al. Kidney Int 2019 Jan;95(1):219-231.
https://pubmed.ncbi.nlm.nih.gov/30420324/
METHODS
Study design and oversight
AURA-LVは活動性LNの患者のMMFとステロイドを使用した上でVCS vs placeboを比較した第2相前向き二重盲検RCT。(略)この研究のprotocolと改訂はCanadaのVictoriaのAurina pharmaceuticals Incでファンドされた。
Study participants
AURA-LV trialの資格は、screening時の6ヶ月以内に腎生検で証明されたClass III, IV or V LNを有する、ACR基準を4項目以上満たす18-75歳のSLE患者. この研究は中央の腎臓病理医ではなく、地域で腎生検の病理を判定されており、この点がlimitationになる可能性はある。Classe III and IV LNの患者は2回連続して朝一の尿検査によるUPCRが>1.5 mg/mg、pure Class V LNはUPCR ≧2 mg/mg である事とされた (Table 1). screening時にthe CKD Epidemiology Collaboration equationに基づくeGFR≦45 ml/min/1.73 m2または血清K>5.5 mmol/Lであった者は除外された。LNの前治療はSupplementary Table S1↓のとおり。患者はscreeningの3ヶ月以内に生物製剤、1ヶ月以内のシクロフォスファミドは投与されていないこととされた.
Treatment protocol
baselineで資格のある患者はlow-dose VCS (23.7 mg twice daily), high-dose VCS (39.5 mg twice daily) or low- or high-dose matched placeboを2:2:1:1の比で割り付けられ、割り付けは腎生検のclass (Class V vs. others)、screening時のMMFの使用で層別化された. randomization block sizeは6、kit numbersは5-digit numberとされた. 割り付けされた患者はcentralized Interactive Web Response Systemを用いて順次的に入手可能なキットの番号を割り当てられた。VCSとplacebo のカプセルは味、におい、見た目も同じで、全ての人・患者が二重盲検法で投与された薬剤にblindされていた。二重盲検のデザインを維持するためplaceboに割り付けられた患者は実薬群とマッチされた。placebo群の半数(n =43)は計6カプセル/日、半数は計10カプセル/日に割り当てられた。placebo群の投与スケジュールは実薬群と同じだった。このように本研究の二重盲検性は実薬とplaceboに関してはblindを保てた。
治験薬は研究を完遂した全患者において48 wk続けられた。たとえCRRを達成していても。Adherenceは受診の度に残薬をカウントして評価され、96.6%と見積もられた. 全ての患者が初期治療としてmPSL, 0.5g/dayをday 0, day 1に投与され、day 2より強制的に経口PSNに変更された. PSNは体重<45 kgなら20 mg/d、≧45 kgなら25 mg/dで開始され、protocol schedule (Figure 1)に従って減量された. 減量scheduleの新しい点はweek 16で2.5 mg/dまで減量しなければならない事だ。これは両群とも75%の患者で達成された。Failureはweek 16-26の間、患者が3日以上PSN >10 mg/dを要した場合、あるいは合計7日以上を要した場合に宣言された. 研究開始時にMMFを投与されていた患者は元々の投与量を継続された. その他の患者はMMFを1g/dで開始し、1週間後2 g/dに増量された。
全ての受診時にeGFR (CKD Epidemiology Collaboration)が測定され、治験薬はeGFRがbaselineに比べ>30%低下した場合は中止された。eGFRの減少が治療以外で説明できない場合、患者は治験薬を中止されたが、通院は続けられた。自動血圧測定機器が可能な限り全ての血圧測定に用いられた。week 4以降、収縮期血圧が≦130 mmHg、拡張期血圧が≦80 mmHgを目標とされ、医師はprotocolで許可される範囲内で可能な限り全ての方法を用いてこの血圧目標を維持するように求められた。但しACE阻害薬とARBは変更しないこととされた。
sample sizeを決定するためにcontrol群のCRRが20%と見込んで、両側検定でp=0.05として、VCSの各群で倍のCRR率(>40%)を81%のpowerで検出するために各群86例が必要とされた(OR=2.78) 。week 24にCRRを達成する患者の割合が各群で決定され、VCSの各群で相対的な寛解率がplaceboと比較された (low and high dose combined=placeboの6 and 10 capsulesのcombinedか). sample size の計算にProc power in SAS (Cary, NC)が使用された. 2つの割合の検定はlikelihood ratio χ二乗検定が使用され、計算されたsample size continuity correctionを用いて調整された.
Outcomes
AURA-LV trial のprimary endpoinは24 week時のCRR. CRRの定義は朝一の尿でUPCR≦0.5 mg/mgが2回、さらにeGFR >60 ml/min/1.73 m2あるいはbaseline eGFRの≧20%の低下が2回連続ない事とされた。研究中に死亡した患者、SLEのためにrescueを要した者、week 16-26に3日連続または計7日以上PSN>10 mg を要した患者はtreatment failureとされた. PSNが増量された患者は2例のみで, VCSの各群1例ずつ。key secondary endpointはCRR rate at 48 wk. SLEの腎外の活動性はbaseline、week 24 and 48にSELENA-SLEDAI scoreを用いて評価された。AEs は系統、臓器、適切な用語で集められ、summary tableで示された. ラボデータ (central laboratoryに基づく)、バイタルサイン、その他安全性のparameterはbaselineからの絶対値と変化量で受診の度にサマライズされた。略
Post-trial follow-up
患者は治験薬が中止された後も研究に残るように依頼されたが、彼らは非常に強力的であった;同意を撤回した患者は合計<10。生存に関する長期の電話によるフォローが6-12 month に行われ(Supplementary Table S4)、回答は良好であった.
Statistical analyses
統計解析のプランは予め定められ解析の進行に応じサインされた。primary endpoint (CRR)と率で測定されたその他のendpointはlogistic regressionを用い、LNのclass分類と screening時のMMF使用の要素で層別化で調整された. その結果はORsで表され、95% CIs and P valueとともに示された. complete remissionのための共変量のカテゴリーは解析プランで予め設定されていて、共変量によるcomplete remissionのオッズはsensitivity analysisとして考慮された. endpointに達成するまでの時間はKaplan-Meier法を用いて解析され、時間を横軸とした生存確率のプロットのグラフで表示された。層別化の変数で調整されたCox proportional hazards modelがhazard ratiosを計算するために用いられた. 死亡はtreatment failureとして処理された. baselineからの変化(SELENA-SLEDAI, UPCR, serum albumin, anti-dsDNA, and complement levels)はANOVAで解析され、目的となった変数のベースラインで補正された。
Figure 1. AURA trial design and corticosteroid tapering protocol

RESULTS
Supplementary Figure 1. Disposition of Study Subjects

AURA-LVはLNの初期治療、MMF+ステロイドにVCSを追加することの有効性と安全性を検証するためにデザインされた(Figure 1). このRCTは米国、Europe、アジアの20ヶ国79センターより265例の患者を登録した。ITT populationで88例がplacebo (44 to low-dose placebo and 44 to high-dose placebo), 89例がlow-dose VCS (23.7 mg twice a day), 88例がhigh-dose VCS (39.5 mg twice a day)に無作為に割り付けられた. 患者層と主なbaseline characteristicsはTable 1.
Table 1. Baseline demographics and disease characteristics

登録までに使用されていた免疫抑制剤と併用薬はSupplementary Tables S1↓ and S2. placebo群では70 例(79.5%)が48 weekの治療を終えlow-dose VCS 73 例 (82.0%)、high-dose VCS 80例(90.9%)と比べられた。群間には数的な差が存在したが(Table 1), これらの差がoutcomeに関連してはいないようであった. 例えばhigh-dose VCS群は男性が少ないため改善が高くなることが考えられたが、実際にはそうではなかった。同様にlow-dose VCS群は白人が少なく無反応が増える懸念があったが、そうではなかった. 本試験のPatient flowはSupplementary Figure S1↑↑.
Table S1. Summary of prior LN treatment

Primary endpoint
24wkのCRR率はlow-dose VCS (23.7 mg twice a day)でplaceboよりも高かった(Figure 2↓). CRRはlow-dose groupの32.6%で達成され (OR=2.03; 95%CI: 1.01– 4.05; P=0.046)、high-dose VCS group では27.3% (OR =1.59; 95% CI: 0.78–3.27; P=0.204)であった;placebo群の19.3%に比べて (Figure 2↓).
low-dose and high-dose VCSともplaceboに比べCRR@wk 48が優れていた(Figure 2). CRRはlow-dose VCS群の49.4% (OR = 3.21; 95% CI: 1.68–6.13; P < 0.001)、high-dose VCS groupの39.8% (OR = 2.10; 95% CI: 1.09–4.02; P = 0.026)で達成された; placebo群の23.9%に比べ.
Figure 2.

Kaplan-Meier曲線を用いて, CRRはplacebo群に比べ両VCS群でより早期に達成された(P < 0.001) (data not shown). CRR達成までの時間の中央値は low-dose VCS群で19.7 week , high-dose VCS群で23.4 week. CRR達成までの中央値はplacebo群では50%生存確率に達成しなかったため計算できなかった。VCSは統計学的に速い時間でpartial remissionにも到達した (UPCRのbaselineからの低下≧50%& rescueなし; data not shown).
さらにVCSは統計学的に有意なUPCR減少と血清Alb増加を示した (Supplementary Figure S2). week 48におけるVCS中止の後UPCRの少しの増加がweek 50までにすべての群で見られたがVCSとplacebo群の有意差は残っていた(P < 0.006).
VCSのweeks24 and 48のCRRに対する治療効果を示唆されたものの統計学的有意差には到達しなかった;sex、screening時のMMF使用、民族、地域、年齢を共変量としたときにおいて (Figure 3).
興味深いのはClass VがVCSで利益を示さなかった事だ.
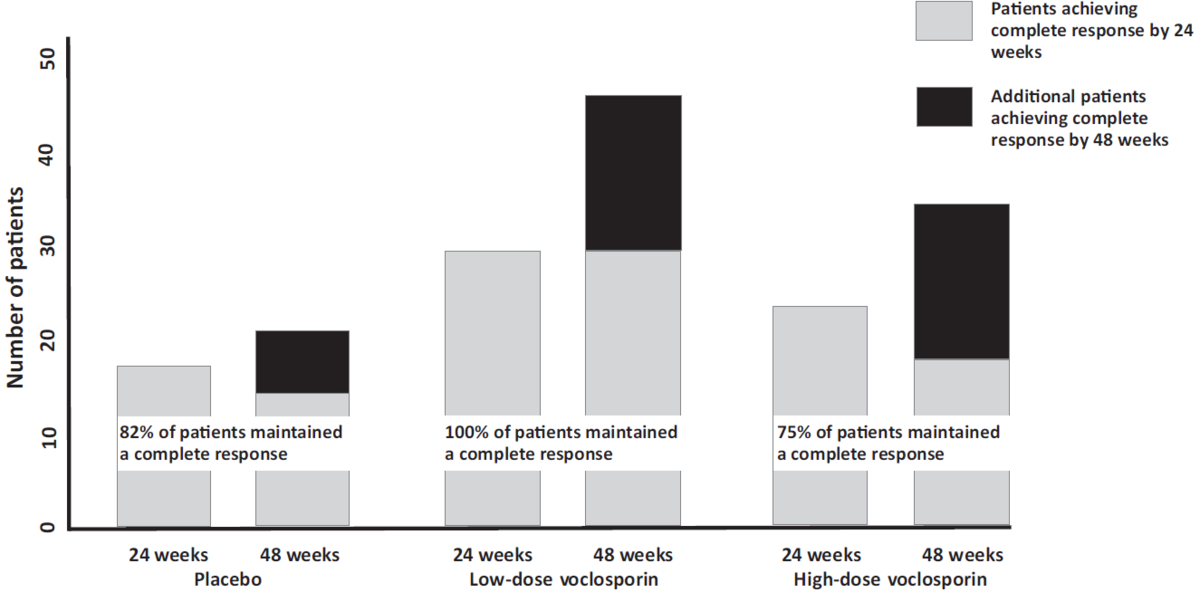
remissionの持続性は全体的に良く、24wkで寛解していたlow-dose VCSの患者全てのおいて48 week時にも寛解が維持されていた(Figure 4).
Figure 3.




Figure 4. Durability of CRR at 24 weeks.
24wkでCRRを達成した患者数、その後の24wkでもCRRを維持した患者数をgray barsで示す. 24 wkまでにCRRを達成しなかったが48wkまでに達成した患者をblack barsで示す
SLEの血清学的マーカー、抗dsDNA抗体、補体は全ての群で時間とともに改善したが(Supplementary Figure S3)、抗dsDNA抗体は24wk、48wk時においてlow-dose VCS群で、week 12, 24, and 48時においてhigh dose VCS群で有意に改善した(P < 0.01). 48 week時、抗dsDNA抗体はplacebo群で7%、low-dose VCS群で51%, high-dose VCS 群で38%低下した.
VCS群におけるSLEの活動性の改善はSELENA-SLEDAI scoreでも見られた. week 48にplacebo群の半数以上(53.4%)がまだSELENA-SLEDAI scores >6 を有していたが、low- and high-dose VCS群では各29.2% and 40.9%であった. SELENA-SLEDAI scoreの改善は主に腎のcomponentの改善によるものであったが、腎外の要素のみで見てみると、VCS群はplacebo群にくらべ同様かそれ以上の改善を示した (Supplementary Figure S4). 例えば腎外のSELENA-SLEDAI scoreはweek 48の時点でplacebo, low-dose VCS, and high-dose VCS の患者で各53%, 51%, and 67%低下した.
Safety/adverse events
Table 2. Overall summary of adverse events (safety set, N=265)

Table 3. Serious adverse events reported by >2% of subjects in any treatment group (safety set, N=265)

AEsはTables 2 and 3にサマライズした. 大多数のAEs and serious AEsは最初の24 weeksに起きた. AEsと治療関連AEsの発生率はhigh-dose VCS患者で増加したが、serious AEsはlow-dose VCS subjects (28.1%)で多かった;high-dose VCS (25.0%) and placebo (15.9%)に比べて.
最も頻度が高いAEsは全ての群で感染症、ついで消化管症状であった. 治療関連に関してInvstigationsの頻度がより高かった;eGFRの評価の必要性を反映するコードであった?(Regarding treatment-related AEs, a higher incidence of Investigations was found, which is a code reflecting the need to assess estimated glomerular filtration rate (eGFR)).
protocolはeGFRの10%を超える変化についてeGFRのアセスメントを強制していた. このアルゴリズムは絶対的な治療関連AEsの増加を促すものであった. 腎機能への実際のインパクトはこの論文で後に議論する. protocolで決まっていたようにeGFR の変化を経験した患者はVCSの投与量を減らしたり一時的に中止したりするために短期間でモニタリングをされた. 全ての患者がprotocolで決められたスケジュールによってモニターされた;たとえ治験薬が永久的に中止されていたとしても。このpracticeは有効性だけでなく安全性に関するデータも完遂することを可能にした.
次に最もコモンな治療関連AEは感染症であったが、群間で実質的な増加は見られず安全性の懸念につながるような、目立った感染症があるようなことはなかった.
13例が研究期間中に死亡し、予想に反し治療群間で不均衡が見られた. low-dose VCS 群において(n = 10, 11.2%) 、high-dose VCS (n = 2, 2.3%) or placebo (n = 1, 1.1%)群と比べ死亡が多かったのだ. 死因の詳細はSupplementary Table S3↓に示す.
Supplementary Table S3. Causes of mortality in LN subjects

ほとんどの死亡 (9/13)がエントリーから最初の2ヶ月以内に起きていた. 6-12ヶ月の間はVCSで治療されていた1例のみ. 半数を超える死亡(7/13)が Bangladeshの2施設で起きていた.この2施設でplaceboよりも2倍多い患者がlow-dose VCSに割り付けられており、死亡の不均衡に関連した可能性がある. 同様にlow-dose VCSで治療され2例が死亡したSri Lankaではplaceboよりも4倍も多い患者がlow-dose VCSに割り付けられていた.
腎機能障害, 高カリウム血漿, 糖尿病, 血圧上昇はCNIsの良く知られたAEsだ. 平均eGFRの若干の増加がVCSの2群で治療期間中見られたが、平均eGFRは研究終了の2wk以内にbaselineに戻った (Figure 5). placebo群の2例, low-dose VCSの3例, high-dose VCSの3例がeGFR低下>30%のためAURA-LVから離脱した. 平均血圧は3群ともbaseline から増加し試験期間中はbaselineよりも低く保たれた(Supplementary Figure S5). VCSは血清カリウム値への影響はほとんどなく (Supplementary Figure S6), このために離脱した者はいなかった。高Mg血症についても同様. 糖尿病はplacebo群の1例、low-dose VCSを投与中の1例に報告された.
研究終了後、安全性のフォローが行われた; AURA-LVの患者を最後の患者が研究を完遂した後3ヶ月、6ヶ月後に彼らの状態を決定するというものだ. placeboで3例死亡したが、VCS群ではさらなる死亡はなかった(Supplementary Table S4).