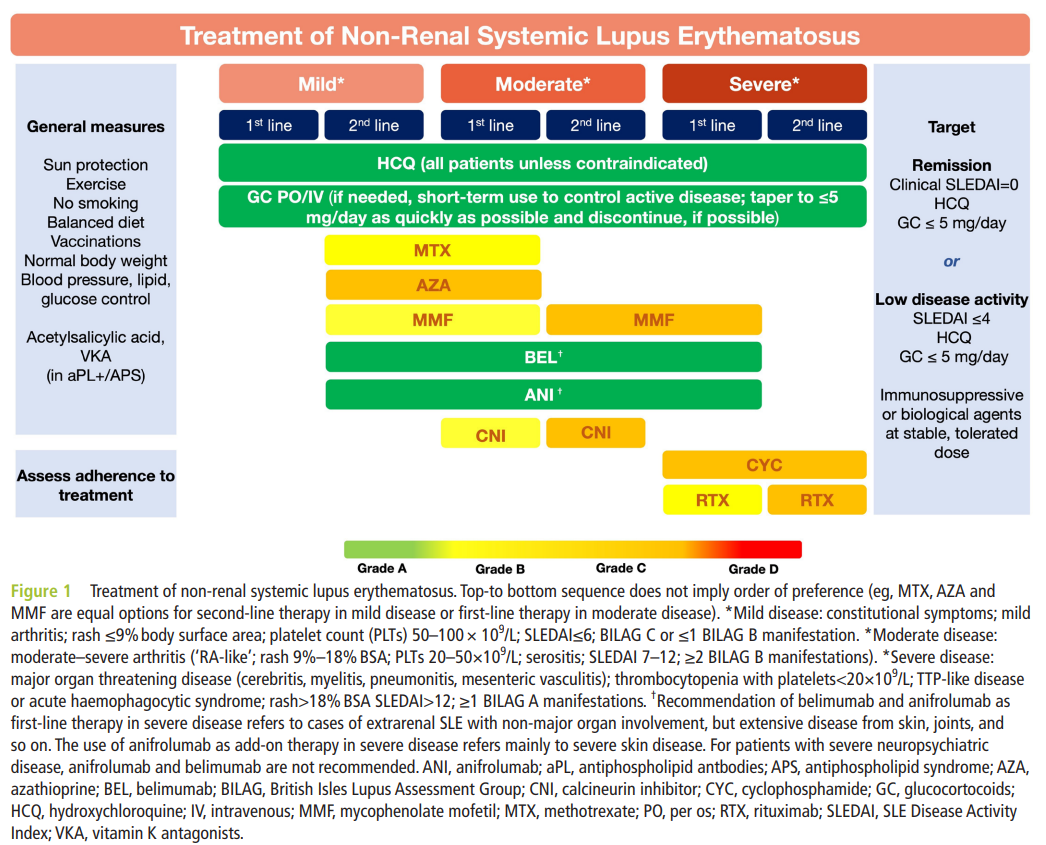
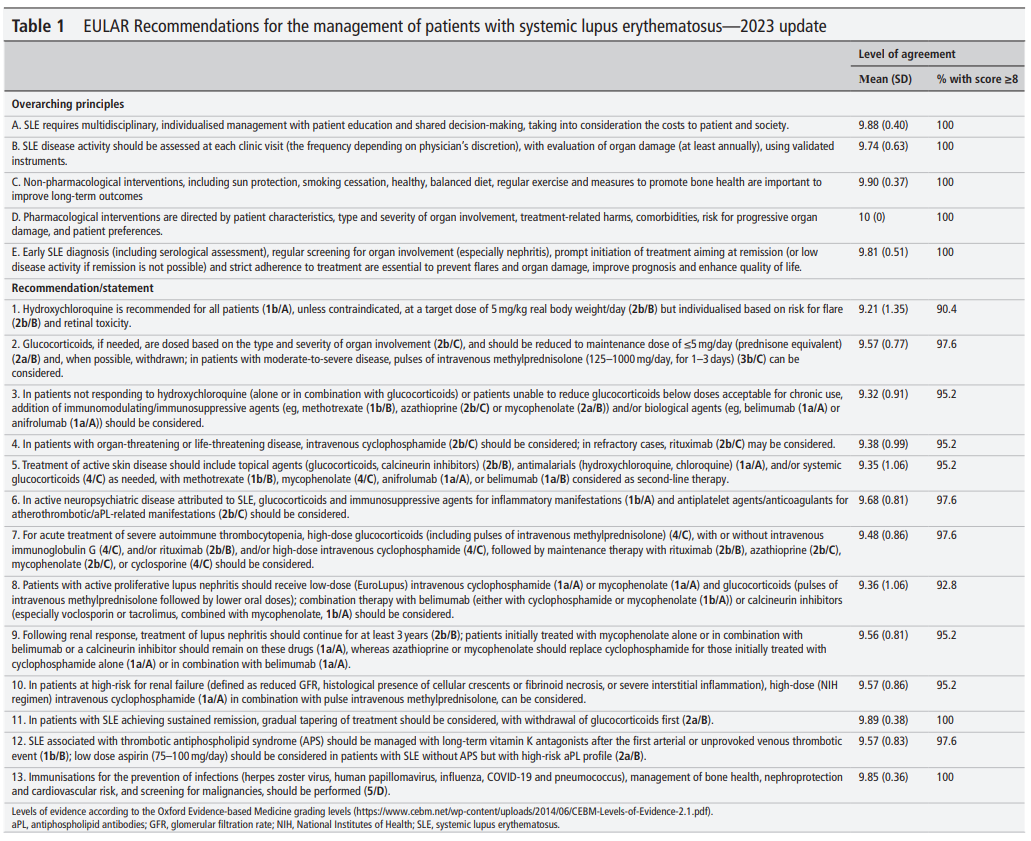
2023 EULAR recommendationsー個々の推奨8-12ー
ref) 2023 EULAR recommendations for SLE
EULAR recommendations for the management of systemic lupus erythematosus: 2023 update - PubMed (nih.gov)
この度はいよいよ腎炎を読み進めていきます。1-7よりも読み応えがありました。個人的にはSGLT-2阻害薬にコメントされていた点が印象的でした。

- Patients with active proliferative lupus nephritis should receive low-dose (EuroLupus) intravenous cyclophosphamide (1a/A) or mycophenolate (1a/A) and glucocorticoids (pulses of intravenous methylprednisolone followed by lower oral doses); combination therapy with belimumab (either with cyclophosphamide or mycophenolate (1b/A)) or calcineurin inhibitors (especially voclosporin or tacrolimus, combined with mycophenolate, 1b/A) should be considered.活動性の増殖性腎炎は低用量(EuroLupus)のIVCYC (1a/A) またはMMF(1a/A)にGC(mPSLパルス後、より低用量の経口GC)の治療を受けるべき; belimumab (either with CYC or MMF (1b/A)) や CNI (特にMMFと併用されたvoclosporinやtacrolimus, 1b/A)との併用療法を考慮に入れるべき。
The recommendation regarding treatment of active LN received the highest attention, in light of the recent approvals of belimumab and voclosporin. Discussions revolved mainly around the position of these drugs in the therapeutic algorithm of LN, that is whether they should be used upfront in an early combination therapy with standard-of-care (SoC, low-dose CYC62 or mycophenolate in combination with GC, see online supplemental table 1 for usual drug doses in SLE), or whether they should be reserved for non-responding or relapsing disease. In this regard, deliberations towards the formulation of this recommendation focused on the following facts: (1) LN is by default severe disease, accompanied by increased morbidity and mortality, and leading to gradual nephron loss and chronic kidney disease (CKD),63 (2) rates of complete response at 1–2 years with SoC therapy (ie, control arms) in recent clinical trials (including the phase 3 trials of belimumab and voclosporin, respectively)64 65 are consistently low, in the range of 20%–30%, and (3) both belimumab and voclosporin based on their RCTs have been approved for all patients with active LN, meaning that all patients can potentially receive them, including as first line. Of note, in a post-hoc analysis of the BLISS-LN, belimumab in combination with SoC was found to reduce the risk for flares by 55% compared with SoC alone, and preserve glomerular filtration rate (GFR) better than SoC.66 67 To this end, the possibility for a universal recommendation of early combination therapy aiming to increase renal response rates was intensively discussed among panellists. 活動性LNの治療に関する推奨は最近承認されたbelimumabとvoclosporinに光が当たり、最も高い注目を受けた。議論は主にLNの治療アルゴリズムにおけるこれらの薬剤の位置づけについて多岐にわたった。つまりこれらの治療法が早期のコンビネーション治療として最初に用いるのか、あるいは治療抵抗性や再発例に温存すべきであるのかについてだ。この点でこの推奨に対する討議が以下の事実にフォーカスされた:①LNは規定では重症の病態であり、合併症と死亡率の増加に関連する。ネフロンが徐々に減少しCKDに至る。➁最近の臨床試験(belimumab、voclosporinのphase3を含む)においても、SoC(つまり、control arm)による1-2年の完全反応率は20-30%と一貫して低い。③belimumab、voclosporinともRCTの結果に基づいて活動性LNの患者すべてに承認された。これはすべての患者が1st lineとしてそれらの治療を受ける可能性があるということである。とくにBLISS-LNのpost-hoc解析ではBelimumabとSoCを併用すればSoC単独と比べ再発を55%減らすこと、SoCと比べeGFRをよく温存する事が分かった。この目的で腎反応を増加させるために世界的な早期の併用療法はパネリストの間で積極的に議論された。
Counterarguments included the high cost of these therapies and the potential of overtreating some patients who would respond to treatment with mycophenolate or low-dose intravenous CYC alone, as well as respective cost or risk considerations, particularly relevant for long-term use of a CNI. Indeed, some patients with LN present with clinically and histologically milder disease, while others with risk factors for progression to end-stage kidney disease; at present, it is unclear which patients will benefit more from early combination therapies. 反論としてこれらの治療のコストが高いこととMMF orlow-dose IVCYに反応するであろう患者に対するovertreatmentの可能性の指摘があった。個々のコストとリスクの考慮、特にCNIの長期使用に関連するもの。確かに臨床的に組織学的に軽症で発症する患者もおり、その一方でその他のESRDの危険因子を有する者もいる。現在のところどの患者が早期の併用療法の利益を得るかについてはわかっていない。
Of note, recent real-life studies have reported higher response rates with SoC, compared with rates reported in RCTs.68 69 Based on all the above, it was proposed that early combination therapy ‘should be considered’ in all adult patients with active LN, emphasising the fact that treating physicians have the option to decide if and when combination therapy should be used. In the case of CNIs, combination refers to voclosporin as well as tacrolimus (TAC), since the current SLR confirmed the superiority of TAC+mycophenolate over SoC (mainly high-dose CYC), although based on evidence exclusively from Asian populations.70
特に最近のreal-lifeの研究はRCTに比べSoCの高い反応率を示している。上述のすべての事に基づき、早期の併用療法が活動性LNの全ての成人患者において「考慮されるべき」であることが提案された。治療医が併用療法を用いるべきか、そしていつ用いるべきかを強調して。CNIについてはTacはもちろんVocの併用を言及している。現在のSLRはTac+MMFよりもSoC(主に高用量IVCYではあるが)の優越性を確認した。アジア人からのエビデンスに限られるが。Additional points regarding the recommendation for LN warrant further clarification: first, no distinction between LN histological classes is made in the recommendation. It should be noted that neither belimumab nor voclosporin induced higher renal response rates versus placebo in a post-hoc RCT analysis of the small subgroup of patients with class V LN.66 71 Nevertheless, patients with pure class V were underrepresented in these trials (less than 20%), and also there were fewer flares with belimumab in the pure V subgroup.LN推奨のさらなるポイントはさらなる分類の正当化する:最初にLNの組織型における区別が推奨ではなされていない。BelimumabもVocも少ない患者群であった5型のPost-hoc解析においてplaceboに比べより高い腎反応を得られなかった。にもかかわらず純粋な5型はこれらの試験では過小に評価されている(<20%)。 Collectively, the Task Force opined that more data are needed to decide on the optimal treatment of class V LN; to provide a succinct message, it was elected that the statement considers patients with any class of LN that needs treatment. Of note, the recommended proteinuria cut-off for immunosuppressive treatment in class V LN remains 1 g/day, as per the 2019 EULAR/ERA-EDTA recommendations.72 Second, the secondary analysis of the BLISS-LN trial found that belimumab was more efficacious in patients with baseline proteinuria below 3 g/day.66 Third, voclosporin provided a rapid reduction in proteinuria, which may be preferable in patients with a high baseline urine protein in the nephrotic range.65 Fourth, in AURORA-1, patients with baseline GFR<45 mL/min were excluded, thus the safety of voclosporin in patients with a low baseline GFR (30–45 mL/min) is as yet unclear. The final decision for the treatment of active LN should depend on the individual patient characteristics as outlined above (histological class, baseline GFR, proteinuria), presence of extrarenal manifestations, comorbidities, risk for toxicity, access to drugs and cost issues, and patient preferences. If a combination therapy is not opted for in patients with treatment-naïve LN, add-on treatment with belimumab or voclosporin should be considered in patients with inadequate response by 3–6 months, or those who flare. In these cases, physicians should consider to acquire expert consultation. 選択的に委員会は5型の治療を決定するためにはさらなるデータが必要であると述べた;簡潔なメッセージを提供するためにステートメントは治療を要する任意のクラスの患者を考える事を選択した。とくに2019 EULAR/ERA-EDTA推奨で言われたように5型の推奨される治療閾値は1gのままだ。次にBLISS-LNの二次解析によってbelimumabはベースラインの尿蛋白<3gの患者においてより有効であることが分かった。3番目にVocは尿蛋白の急速な減少をもたらし、Nephrotic rangeの高い尿蛋白の患者には好まれるかもしれない。4番目にAURORA-1はeGFR<45の患者は除外されており、eGFR30-45の患者における安全性はいまだにわかっていない。活動性LNの治療のための最後の決定は上述の個々の患者の特徴(組織、eGFR、尿蛋白)、腎外症状、併存疾患、毒性のリスク、薬剤へのアクセスとコストの問題、患者の好みによって決められるべきである。併用療法が無治療の患者に向けられない場合、追加のbelimumabやVocを3-6か月の治療で反応しない患者や再発する患者には考慮されるべき。これらのケースでは医師は専門医のコンサルテーションを考慮すべき。
Regarding dosing of GC, pulses of intravenous MP (eg, 250–1000 mg for 1–3 days) are recommended as part of the initial (or ‘remission induction’) regimen, unless there are major safety concerns (eg, infection). For oral therapy, large controlled trials comparing different GC regimens have not been performed in LN. The 2019 EULAR/ERA-EDTA recommendations endorsed a lower dose GC regimen for initial therapy compared with traditional practices (starting dose 0.3–0.5 mg/kg/day and 20 mg/day for proliferative classes and class V, respectively), though acknowledging that this was not based on high-quality data.73 In the current version of recommendations, the principle for lower cumulative GC exposure was maintained. Importantly, belimumab demonstrated superior GC-sparing potential than SoC in the BLISS-LN study, while the AURORA study of voclosporin used significantly lower GC doses than earlier studies (20–25 mg/day starting oral prednisone rapidly tapered to 5 mg by 12 weeks), lending further support to their use in LN. A recommended GC initial dose and tapering strategy is shown in online supplemental table 1. GC投与量については静注mPSL(250-1000mg,for1-3days)が初期治療(または寛解導入療法)の一部として推奨される。感染症のような主要な安全性の懸念がない限り。経口治療として異なるGCのレジメンを比較した大きな比較試験はLNは存在しない。2019EULAR/ERA-EDTA推奨は従来のプラクティスに比べより少ないGCレジメンを初期治療として支持した(増殖型には0.3-0.5mg/kg、5型には20mg/d)。これが質の高い研究に基づくことを認めている。現在の推奨ではより低い累積GC暴露量の方針が維持されている。重要なことはBelimumabはSoCに比べGC-sparingの効果が優れている事が示されている。一方のVocのAURORAは従来の試験に比べ有意に少ない量のGCを用いており、その使用をさらに支持する(20-25mg/dで開始し12wkで5㎎にする)。推奨されるGCの初期投与量と減量方針はonline supplemental table 1に示されている。The overall agreement for this recommendation was 92.8%, with a mean (SD) LoA of 9.36 (1.06). TMAがLNの組織の20%までに見られ、特にaPLの存在に関連し、予後不良に関連する。ステートメントで言及はされていないが、TMA-LNの治療選択は議論された。高い質の研究はなかったが。抗凝固療法に加え、補体関連TMAで有効である補体蛋白のC5に対するモノクローナル抗体、eculizumabのエビデンスが出現してきている。組織学的にTMAを有するLN患者において。
Thrombotic microangiopathy (TMA) may be evident in up to 20% of LN biopsies, particularly in the presence of aPL, and is associated with an adverse impact on prognosis. Although not mentioned in the statement, treatment options in TMA-LN were discussed, even though high-quality data are lacking. In addition to anticoagulation therapy,74 there is emerging evidence for the use of eculizumab, a monoclonal antibody against complement protein C5 which is efficacious in cases of complement-mediated TMA, for patients with LN and histological evidence of TMA.75
- Following renal response, treatment of LN should continue for at least 3 years (2b/B); patients initially treated with mycophenolate alone or in combination with belimumab or a calcineurin inhibitor should remain on these drugs (1a/A), whereas mycophenolate or azathioprine should replace cyclophosphamide for those initially treated with cyclophosphamide alone (1a/A) or in combination with belimumab (1a/A).腎反応に次いで、LNの治療は少なくとも3年は続けるべき(2bB);MMF単独、あるいはbelimumabまたはCNIで治療された患者はこれrな治療を継続すべき(1a/A)。MMFやAZはCY単独(1a/A)またはCY+Belimumab(1a/A)で初期治療された患者においてCYにとって代わるべき。
Following the choice of initial treatment, renal response should be monitored according to the 2019 EULAR/ERA-EDTA targets (reduction in proteinuria ≥25% and 50% at 3 and 6 months, respectively, and below 500–700 mg/day at 12 months, all with GFR within 10% from baseline). These therapeutic goals have now been validated.76 Provided that response is achieved, subsequent (or ‘maintenance’) therapy should depend on the initial regimen. If the initial regimen included mycophenolate (either monotherapy or in combination with belimumab or voclosporin), then the same regimen should continue for at least 3 years; on the other hand, if low-dose CYC had been initially used, alone or in combination with belimumab, it should be replaced by mycophenolate or AZA while belimumab should be continued (if used initially).初期治療の選択についで腎反応は2019EULAR/ERA-EDTAの目標(尿蛋白は3か月で25%以上、6か月で50%以上の改善、12か月後は500-700mg/d以下。いずれの場合もGFRはbaselineから10%以内の低下に留まること)。これらの治療ゴールは現在妥当性が示されている。腎反応が得られた場合、続く維持療法は初期レジメンに従うべき。もし初期治療がMMFを含んでいたのであれば(単剤でもbelimumab、Vocとの併用であっても)、同じレジメンを少なくとも3年続ける;一方でlow-dose CYCで初期に治療されていたのであれば、単剤であってもbelimumabとの併用であっても、MMF orAZに変更されるべき。Belimumabは継続されるべき(初期で使用されていたのであれば)。
Duration of immunosuppressive therapy was also intensively discussed. Immunosuppressive treatment in LN, particularly in proliferative classes, should continue for at least 3 years.77 Of note, in case of initial therapy with mycophenolate/CNI combination, there is a concern regarding the duration of therapy, as long-term use of ‘legacy’ CNIs (tacrolimus, cyclosporine A) has been associated with nephrotoxicity and GFR decline. Several Asian RCTs have investigated CNI combination therapy as remission induction, but not as a long-term maintenance therapy.78 79 In this regard, it is reassuring that the long-term AURORA-2 study extending to 3 years use of voclosporin/mycophenolate combination recently reported stable levels of GFR throughout the 3-year period.80 免疫抑制療法の期間も積極的に議論された。LNの免疫抑制療法は特に増殖性腎炎であれば少なくとも3年は続けられるべき。とくにMMF+CNIの併用でt量されあ患者では治療期間について懸念がある。長期の遺産的CNI(tacrolimus、cyclosporinA)は腎毒性とGFR低下に関連するため。いくつかのアジアのRCTはCNI併用療法を寛解導入で用い、長期の維持療法では用いていない。この点、AURORA-2の3年までの延長試験ではVoc+MMFとの併用が3年間を通してGFRを維持したと最近報告された。This recommendation was agreed on by 96.4% of participants and mean (SD) LoA was 9.56 (0.81).
- In patients at high risk for kidney failure (defined as reduced glomerular filtration rate, histological presence of cellular crescents or fibrinoid necrosis, or severe interstitial inflammation), high-dose (National Institutes of Health regimen) intravenous cyclophosphamide (1a/A) in combination with pulse intravenous methylprednisolone can be considered.腎不全のハイリスク患者(GFR、細胞性or線維性半月or重症の間質炎)では、高用量のIVCY(NIHレジメン)をmPSLパルス療法と組み合わせて用いることを考慮してもよい。A subset of patients with LN present with baseline clinical and histological characteristics associated with an adverse long-term prognosis. Such patients can still be treated as in recommendation nr. 9, but it should be noted that patients with such characteristics are underrepresented or excluded in all recent trials in LN (eg, the BLISS-LN and AURORA-1 excluded patients with GFR<30 and ≤ 45 mL/min/1.73 m2, respectively). Thus, the relative efficacy of these regimens in patients at high risk for kidney failure is currently unclear. A small (32 patients) post hoc analysis of the Aspreva Lupus Management Study found similar response rates (proteinuria and serum creatinine) between mycophenolate and high-dose intravenous CYC.81Thus, for patients presenting with impaired kidney function or histological evidence of crescentic glomerulonephritis and/or severe interstitial inflammation, the traditional high-dose intravenous CYC regimen (0.5–0.75 g/m2monthly for 6 months) can also be considered, since it is the most extensively studied therapeutic regimen in severe LN, in the early studies from the NIH. Importantly, this recommendation received 100% agreement among Task Force members, and a mean (SD) LoA of 9.57 (0.86). LNの一部は長期予後が良くない事と関連するbaselineの臨床的、組織学的特徴を伴って発症する。そのような患者では推奨No.9に記載されているように治療できるが、そのような特徴を有する患者はエビデンスが不十分であるか最近のLNの全ての臨床試験で除外されている(例えばBLISS-LNやAURORA-1はGFR<30and≤45の患者を除外した)。このようにハイリスクの患者において相対的にこれらのレジメンの効果があるかどうかは分かっていない。ALMS研究の小さなpost-hoc解析(n=32)ではMMFと高用量IVCYとの間で同様の反応率(尿蛋白とCr)を示した。このように腎機能障害のある患者や組織学的に半月体系聖性腎炎and/or重症の間質炎がある患者ではtraditionalな高用量のIVCYCレジメン(0.5-0.75g/m2/月×6か月)を考慮してもよい。重症LNで最も広範囲に研究された治療レジメンであるため(NIHからの早期の研究)。大切なことに、この推奨は委員会のメンバーで100%の同意が得られLoAも9.57(0.86)であった。
- In patients with SLE achieving sustained remission, gradual tapering of treatment should be considered, with withdrawal of glucocorticoids first (2a/B).持続寛解を達成したSLE患者では治療の漸減を考慮すべき。まず最初はステロイドの中止から(2a/B)。
The possibility of tapering immunosuppressive treatment in patients with SLE with quiescent disease was a specific research question for the SLR, and concerned GC, immunosuppressive drugs (conventional and biological), and finally, HCQ (in this sequence). Regarding GC, a meta-analysis calculated a 24% pooled incidence of SLE flares following GC discontinuation, but relative risk for major flares was not increased compared with patients who continued GC.82 In an investigator-initiated study from France, discontinuation of prednisone in patients who had clinically quiescent disease for more than 1 year and received stable 5 mg/day proved inferior to continuation of the same dose, in terms of risk of disease flares.83 Caveats of this study were discussed between Task Force members, mainly the abrupt discontinuation of prednisone and the fact that biological agents like belimumab were not received by any patient. It was decided that these limitations, together with observational studies that have shown no increased risk of flares with gradual tapering of GC to complete withdrawal84 85 and the detrimental effects of long-term GC use, allow for a recommendation that gradual GC tapering to discontinuation should be attempted in SLE, in line with current recommendation 2.安定したSLE患者の免疫抑制療法を漸減する可能性はSLRの特別なリサーチクエスチョンであり、GC、免疫抑制剤(conventionalとbiological)、最終的にHCQ(この順で)が関係した。フランスで医師主導研究において>1年の間PSN 5mg/dで臨床的に安定している患者においてPSNを中止する事は、同じ量を継続する場合に比べ再燃という点において劣っていることが分かった。この研究の注意事項が委員会の間で議論された。主にPSNの突然の中止とbelimumabのような生物製剤を投与されていた患者はいなかった。これらのlimitationのため、またGCを徐々に漸減して完全に中止するという観察研究の結果、長期GCの有害事象も加味して、GCを徐々に減量して中止することをSLEで試みるべきである、という推奨が可能であると判断された。これは現在の推奨2とも沿ったものだ。
Regarding immunosuppressive agents, a second investigator-initiated RCT (Weaning of Immunosuppression in Lupus, WIN-LUPUS) tested whether withdrawal of mycophenolate or AZA after 2–3 years of therapy in LN would be non-inferior to continuation for the occurrence of renal relapses. The study failed to show non-inferiority, as patients in the discontinuation group had more relapses of LN and more extrarenal flares.77 On the contrary, similar to GC, uncontrolled observational studies have reported successful withdrawal of immunosuppressive therapy in LN. Of note, the total duration of therapy as well as of remission prior to discontinuation of immunosuppressive drugs are particularly important in the LN setting86 87; patients should have received at least 3–5 years of therapy and be in remission for at least 2 years before withdrawal can be attempted. Prior to withdrawal, tapering should be undertaken very gradually. A repeat kidney biopsy-guided decision for therapy withdrawal in patients in clinical remission, in order to assess for residual histological activity predictive of a subsequent flare, is supported by recent observational studies and could be considered, although this has not been formally tested in a RCT.88 89
免疫抑制剤については2つ目の医師主導試験のRCT(Weaning of Immunosuppression in Lupus, WIN-LUPUS)がLN治療を2-3年行った後にMMFやAZを中止することが継続した場合と比べて腎再燃の発生に比べ劣っていないかを検証した。この研究は中止群でLNの再燃、腎外の再燃が増えたため、非劣性を示すことはできなかった。一方、GCと同様に比較試験でない観察研究がLNの免疫抑制剤の中止が上手くいくことを報告している。特に治療期間の長さ、IS中止までの寛解の持続期間がLNでは重要である;中止を試みられるのであれば、その前に患者は少なくとも3-5年の治療を受け、2年以上寛解している必要がある。中止の前に緩徐に減量されるべき。臨床的に寛解している患者において、再燃を予測する組織学的活動性の残存を調査する目的で繰り返しの腎生検でガイドされた治療中止の決定は最近の観察研究で支持されており、考慮されてもよい。ただしこの方法はRCTでテストされていない。Contrary to GC and immunosuppressive drugs, HCQ should not be discontinued in patients with SLE in the absence of unacceptable side-effects; in addition to its multiple benefits including survival,90 the SLR concluded that HCQ discontinuation is associated with increased risk for flares (data from observational studies).91–93 Additionally, HCQ therapy is a protective factor against disease relapse in patients discontinuing GC or immunosuppressive agents.86 94 Although complete discontinuation is discouraged (with the exception of adverse effects), data on tapering/dose reduction are equivocal91 92; thus, a decision for HCQ dose reduction in patients in remission should be taken on an individualised basis.GCとISとは異なりHCQはSLE患者で中止すべきではない。容認できない副作用がない限り;生存を含む多くの利益に加え、SLRはHCQ中止は再燃リスクの増加に関連していると結論づけた(観察研究からのデータ)。加えてHCQはGCやISを中止した患者において疾患の再燃に対し保護的である。完全な中止は進められないが(副作用の場合を除き)、HCQ漸減・中止のデータはequivocalである。このように寛解状態にある患者においてHCQの投与量の減量を決定することは個々の状況に応じて決定されるべき。
Importantly, the statement on tapering treatment in quiescent SLE received the highest LoA between members, 100%, and mean (SD) LoA 9.89 (0.38).
- SLE associated with thrombotic antiphospholipid syndrome (APS) should be managed with long-term vitamin K antagonists after the first arterial or unprovoked venous thrombotic event (1b/B); low-dose aspirin (75–100 mg/day) should be considered in patients with SLE/without APS with high-risk aPL profile (2a/B).血栓性APSを合併したSLEは長期のビタミンK阻害薬で管理されるべき。最初の動脈性or誘因のない静脈血栓症の後に(1b/B);ハイリスクのaPLプロフィールを有するSLE患者ではAPSを合併していなくても低用量アスピリン(75-100 mg/d)での治療を考慮されるべき(2a/B)。
Patients with SLE with concomitant APS represent a challenging endotype of the lupus spectrum. To this end, although EULAR has published specific recommendations for the management of APS in 2019,95 it was decided that the significance of SLE-APS merits a specific question for the SLR. Management of definite SLE-aPL/APS should follow the same principles of therapy as primary APS, including the long-term use of vitamin K antagonists in patients with unprovoked venous and those with arterial thrombotic events.95 After the first RCT on novel direct oral anticoagulants (DOACs) in APS (Trial of Rivaroxaban in AntiPhospholipid Syndrome trial), based on which the 2019 EULAR recommendations for the management of APS recommended against their use in patients with triple aPL positivity or prior arterial thrombosis, three additional RCTs compared vitamin K antagonists versus DOACs in patients with thrombotic APS.95 A recent meta-analysis of these trials showed that DOAC use was associated with increased risk of subsequent arterial thrombotic events (OR: 5.43), especially stroke (OR: 10.74), and the composite of arterial or venous thrombotic events (OR: 4.46).96 In patients who have not experienced a thrombotic event, primary prophylaxis with low-dose aspirin should be considered in those with a high risk aPL profile, defined as lupus anticoagulant positivity, or double (any combination of lupus anticoagulant, anticardiolipin antibodies or anti-beta2glycoprotein I antibodies) or triple aPL (all three aPL). APS合併のSLE患者はループスのスペクトラムの中で難しいエンドタイプである。この管理においてEULARは2019年にAPS管理に特化した推奨を出版したが、SLE-APSの重要性はSLRの特異的な質問に値すると決定された。SLEのAPSの管理は原発性APSとして同じ治療方針に従うべき。これには誘因のない静脈血栓症と動脈血栓症の患者における長期のビタミンK阻害薬を含まれる。APSにおけるDOACsに関する最初のRCT(Trial of Rivaroxaban in AntiPhospholipid Syndrome trial)の後、これに基づいてAPS管理の2019EULAR推奨がtriple aPL+や過去の動脈血栓を有する患者にDOACsを使用しないよう推奨したが、そのRCTの後、3つのRCTが血栓性APSにおいてビタミンK阻害薬とDOACsを比較した。最近のメタ解析はDOACの使用はその後に起きる動脈血栓性イベント(OR: 5.43)、とくに脳梗塞(OR: 10.74)と動静脈血栓イベントの合併(OR: 4.46)を増やすことに関連した。血栓症のない患者ではハイリスクのaPLプロフィールを有する場合に低用量のアスピリンを考慮するべきである。ハイリスクとはLA+またはdouble positive(LA、aCL、抗β2GPI抗体の任意の組み合わせ)またはtriple positiveで定義される。HCQはその有益な効果とは別に抗血栓作用を有しaPLの値を下げるかもしれない。そのため特にSLE-aPLやSLE/APS患者に推奨される。Apart from its other beneficial effects, HCQ has also potential antithrombotic effects and may reduce aPL levels,97 and is particularly recommended in patients with SLE-aPL or SLE/APS.98 99
Catastrophic APS (CAPS) is a rare complication of APS, with concomitant or successive thrombosis in≥3 organs. Although a detailed overview of the therapeutic options for CAPS was outside the scope of the SLR, several Task Force members deemed it important to cover this issue in the manuscript text. High-quality studies for the treatment of CAPS in SLE are lacking. Precipitating conditions (eg, infections) should be aggressively sought for and treated, to minimise the risk for the development of CAPS. Triple therapy with full anticoagulation, high-dose GC and plasma exchange and/or IVIG is recommended for patients with CAPS; more recently, the complement inhibitor eculizumab has shown promise, especially in patients with CAPS with features of complement-mediated TMA (microangiopathic haemolytic anaemia, thrombocytopenia, acute kidney injury). 100 The 2019 EULAR recommendations for the management of APS stated that complement inhibitors or RTX may be considered in refractory CAPS. CAPSはAPSの稀な合併症であり、同時または連続する3臓器異常の血栓症である。CAPSの治療選択に関する詳細なoverviewはSLRの範囲に含まれなかった。SLEにおけるCPASの質の高い研究がない。感染症のような先行病態を積極的に検索され、治療されるべき。CPAS進展のリスクを最小限にするために。フルの抗凝固のためのtriple therapy、高用量GC+PEand/or IVIGがCAPSでは考慮される;最近では補体阻害薬のeculizumabが特に補体介在性TMA(微笑血管障害性溶血性貧血、血小板減少症、急性腎障害)の所見を呈するCAPS患者に有望視されている。Agreement for this recommendation was 96.4% and mean (SD) LoA was 9.57 (0.83).
- Immunisations for the prevention of infections (herpes zoster virus, human papillomavirus, influenza, COVID-19 and pneumococcus), management of bone health, nephroprotection and cardiovascular risk, and screening for malignancies, should be performed (5/D).感染症予防に対する免疫(HZV、ヒトパピローマウイルス、インフルエンザ、COVID-19、肺炎球菌)、骨健康の管理、腎保護、新血管系リスク、悪性腫瘍のスクリーニングを施行すべき(5/D)。
The final recommendation is a statement regarding major comorbidities in SLE, reflecting expert opinion based on the evidence for the general benefit of the mentioned measures. As on APS, EULAR has issued specific recommendations regarding vaccinations101 and cardiovascular risk management102 in patients with autoimmune rheumatic diseases, including SLE, and the reader is referred to the respective manuscripts for further details. 最後の推奨はSLEにおけるメジャーな併存疾患に関するステートメントである。これは上述の項目の一般的な利益のエビデンスに基づくexpert opinionを反映したものである。APSにおいてEULARはSLEを含む自己免疫性リウマチ性疾患を有する患者におけるワクチンと心血管リスクに関する特異的な推奨を発刊した。詳細は各原稿を参照されたい。In view of the COVID-19 pandemic and the burden of herpes zoster in patients with lupus,103 the current SLR included a research question regarding the efficacy and safety of vaccines against SARS-CoV-2 and herpes zoster virus (HZV) in lupus. COVID-19 pandemicとSLE患者における帯状疱疹の負荷の観点から、現在のSLRはSARS-CoV-2とHZVに対するワクチンの効果と安全性に関するリサーチクエスチョンを含んだ。Both the live attenuated and the more efficacious recombinant zoster vaccine have been used in patients with SLE and, although studies are limited, they are considered safe.104 105 Similarly, several observational studies have proven the immunogenicity and safety of SARS-CoV-2 vaccines, which are recommended for patients with SLE.106 Prompt identification and management of infections/sepsis are essential in SLE, and vigilant monitoring for opportunistic infections is warranted in selected patients receiving potent immunosuppressive drugs (eg, high-dose GC, CYC, RTX).107 In patients with LN, adjunct treatment with nephroprotective agents is of utmost importance to decelerate nephron loss, in combination with immunosuppressive therapy. Renin–angiotensin–aldosterone blockade is required, unless not tolerated, to control hypertension (target level below 130/80 mm Hg).108 More recently, novel classes of agents, mainly sodium glucose transport 2 (SGLT-2) inhibitors (‘flozins’), have gained attention as kidney protective drugs for any case of CKD; SGLT-2 is expressed in kidney biopsies of patients with LN,109 and its targeting seems reasonable. 生ワクチンも、より効果の高いリコンビナント帯状疱疹ワクチンもSLE患者で用いられてきた。これらの研究はlimitationもあるが、安全と考えられる。同様にいくつかの観察研究においてSARS-CoV-2の免疫原性と安全性を示し、SLE患者で推奨される根拠となった。SLEでは速やかに感染症・感染症を発見し治療することは大切である。免疫抑制療法中の(high-dose GC, CYC, RTX)を使用している一部の患者では日和見感染症の注意深いモニタリングが正当化される。LNの患者では免疫抑制療法に加え腎保護作用のある補助的な治療がネフロンの消失を減らすために重要である。高血圧の管理のため(130/80未満が目標)RAS系阻害薬が不耐でない限り必要である。最近では新しいクラスの薬剤、SGLT-2阻害薬がCKDの任意の症例で腎保護作用として注目されている;SGLT-2はLN患者の腎組織にも表現されており、それをターゲットとすることは妥当にみえる。A preliminary study of dapagliflozin in a small number of patients with SLE (18 with LN) found no difference in proteinuria following therapy.110 Until more data are available, SGLT-2 inhibitors may be considered in patients with LN with reduced GFR below 60–90 mL/min or proteinuria more than 0.5–1 g/day, on top of ACE/ARBi during the maintenance phase. Dapaglifloziの暫定的な研究が少数のSLE患者(LN18例)で評価され、治療後の尿蛋白の有意な改善は示されなかった。もっとデータが入手できるようになるまでSGLT-2阻害薬は維持期にはACE/ARBiに加えてGFR<60-90または尿蛋白0.5-1.0のLN患者で考慮してもよい。The final recommendation received 92.8% agreement and mean (SD) LoA was 9.85 (0.36).
ps;
2023 EULAR recommendations for SLEー全般的指針ー - リウマチ膠原病のQ&A (hatenablog.com)
2023 EULAR recommendations for SLEー個々の推奨1-7ー - リウマチ膠原病のQ&A (hatenablog.com)