Dr. MokはHonk Kongのアジアのループス腎炎のauthorityです。過去にはAsian guidelinesを作られたり、Nat Rev Rheumatolにレビューを書かれたりしています。
https://onlinelibrary.wiley.com/doi/full/10.1111/1756-185X.12212
https://oiwarheumatology.hatenablog.com/entry/14943368
なかでも、Tacrolimus vs MMFのRCTは、ループス腎炎の寛解導入療法におけるIVCY vs MMFの2強の構図に新たな可能性を提供するデータとなりました。
そのRCTは2016年に報告され、このブログでも触れておりましたが、
https://oiwarheumatology.hatenablog.com/entry/14926396
この度、約10年後の長期成績が報告されたので、まとめます。
Long-term Outcome of a Randomised Controlled Trial Comparing Tacrolimus With Mycophenolate Mofetil as Induction Therapy for Active Lupus Nephritis
Chi Chiu Mok, et al.
https://pubmed.ncbi.nlm.nih.gov/32448782/
Patients and Methods
Study populationは最初の報告のとおり。
https://oiwarheumatology.hatenablog.com/entry/14926396
Long-term clinical outcomes
このRCTに参加した患者は同じ医師たちによってフォローされた。私たちは登録された患者全てを対象として、10年後のアウトカムをIntention to treat (ITT) ベースで調査した。寛解導入療法 or 再導入療法後の維持療法にかかわらず。
これらのアウトカムには
・腎炎の再発率 (尿蛋白、腎炎)、
・非腎症の再発、
・腎機能低下 (≥30%のeGFRの低下)、
・CKD stage 4/5 (eGFR<30 mL/min)、
・死亡
を含み、MMF とTAC 導入群で比較した。
腎予後不良の腎予後不良に関連する因子について統計解析を行った。腎炎のパラメーター、すなわち(6-24ヶ月の間で)異なるタイミングでのUPCR、eGFRの10年後の腎予後不良を予測する価値を調査した。
尿蛋白の腎再燃をCR後の尿蛋白上昇>2g/day、あるいはPR後の尿蛋白(またはUPCR)の二倍化(血清Cr上昇の有無に関わらず)と定義した。活動性尿沈渣の悪化または再発(RBC or 円柱)、および尿蛋白or UPCR or 血清Crの30%以上の上昇(他の原因によらない)は腎炎の再燃としてよいだろう。腎外の再燃とは治療強化を要する腎炎以外の臨床所見と定義した。
SLEの臓器ダメージはSLICC/ACR damage index (SDI)で評価された。SLE診断後のダメージはスコアリングの前に6ヶ月以上存在するものとした。原因によらないものとし非可逆性のものとした。
Results
150例の活動性LNが2005-2012年の間、MMF (n=76) or TAC (n=74)に割り付けられた. 女性138例 (92%) であり、ISN/RPSの組織分類はIII±V 36%; IV G/S±V 46%; pure V 19%であった。登録時の平均年齢は35.5±12.8 際で、平均的な組織学的activity and chronicity scoreは8.2±3.4 and 2.6±1.6。59例 (39%) に高血圧があり、62例 (41%) が活動性の尿円柱を有した。112例 (75%) が潜血を有し、67% がeGFR<90 mL/min。2つの治療群の臨床背景に有意な違いはなし。その際報告したとおり、6ヶ月後のCR (primary end point) はMMF 59% 、TAC 62% (difference 3% (−12% to 18%); p=0.71).
#ここの詳細は↓
https://oiwarheumatology.hatenablog.com/entry/14932942
Renal flares over time
AZAによる維持療法はMMF群59例 (78%) (AZAの投与量82.5±24 mg/日)、TAC群60例 (81%) (86.5±21 mg/日; p=0.32)。4例でAZAに耐用できなかった (無顆粒球症(n=2), 播種性結核(n=1)、胃腸障害 (n=1)。3例は妊娠のため中止された。これらの6例は維持療法として低用量のシクロスポリンに変更された。6ヶ月後に反応を示さなかった患者は別なレジメンを再導入された;高用量プレドニゾロンとCYC (n=20), 低用量のMMF+TAC (n=5), TACへのクロスオーバー (n=4) or MMFへのクロスオーバー (n=2)。成功的な再導入療法の後に維持療法の選択は主治医の判断によった。
フォローが中止された者はいなかった。平均118.2ヶ月(±42)、尿蛋白の再発はMMF群で34%、TAC群で各53% (p=0.02)、腎炎の再発は各37% 、30% (p=0.36)。MMFで治療された43例の患者のうち合計77回の腎炎のフレアがあった (0.11/人年。TACで治療された46例(62%)のうち92回であった (0.12/人年; p=0.23)。これらの再治療のレジメンはonline supplementary table 2にサマライズした。プレドニゾロンの投与量は0.4 - 0.8 mg/kg (減量する前に4–8 週間)。MMF群において数的に多い患者がCYCで治療された。
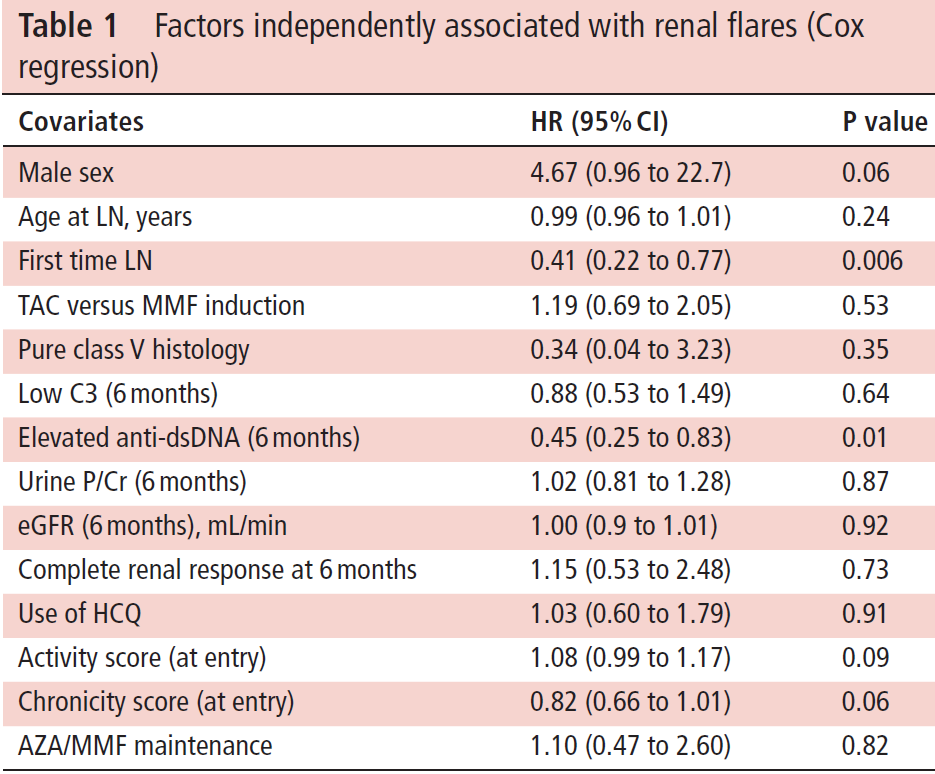
MMF/AZAで治療された患者において腎炎の累積再発率は3年で28%、5年で42%、10年で58%。一方のTAC/AZAでは3年で32%、5年で53%、10年で66% (log rank test; p=0.43) (figure 1).
Figure 1. Cumulative incidence of renal flares (any) over time.

Cox regression解析は初発時のLN (HR 0.41 (0.22 to 0.77); p=0.006)、6ヶ月時までのanti-dsDNA抗体の持続的陽性(HR 0.45 (0.25 to 0.83); p=0.01)が観察期間中の腎炎の再燃と関連することが示唆された(table 1)。男性患者はより頻回に再燃しやすい傾向があったが、有意差には到達せず (HR 4.67 (0.96 to 22.7); p=0.06)。
純粋な膜型LNの患者(n=28)、および6ヶ月の時点で再導入療法を要さなかった患者(n=119)のサブグループにおいて腎炎再燃の累積発生率をSupplementary Figure 1 and 3(#略)に示す。TAC、MMF群の間で差はなかった。
Supplementary Figure 1: Cumulative rates of renal flares (any) over time in patients with pure membranous LN (N=28)

Repeated renal biopsy
腎生検は40例において主に腎炎の再燃のため繰り返された。4例のデータは糸球体の数が不十分であったため使用できなかった。残りの患者では(MMF、TAC群とも18例)、最初の生検からの感覚は各78.2±36 and 67.8±40ヶ月 (p=0.40)。MMF群の5例、TAC群の4例が再生検の前にCNIsに暴露された。理由は難治性の腎疾患あるいはSLEの再燃のため再度の導入療法を行ったため。組織のchronicity scoreは両群で有意に違いはなかったs (1.29; 95% CI (−0.21 to 2.78) in MMF and 1.64; 95% CI (0.43 to 2.85) in TAC; p=0.69)。
Non-renal flares
MMF群の患者では、腎外ループスの再燃が100人年あたり8.3人 (0.083/人年)に起きた。TAC群の9.1人 (0.091/人年)と比べ差はなし(p=0.64)。粘膜、関節炎、漿膜炎、血液学的、神経性神学的なSLEの再燃はMMF群、TAC群で差はなかった (p値は全ての比較で有意ではなかった;figure 3)。これらの再燃の治療レジメンはonline supplementary table 2(#略)に示す。一日のPSL量は0.2 - 0.4 mg/kg (for 2–4 weeks)であった。同時の腎炎や腫瘍臓器の再燃がない限り。
Organ damage over time
時間とともに新たな臓器ダメージを起こした患者の割合はMMF群とTAC群で同等(45% vs 47%; p=0.75)。SDI scoreのベースラインからの増加はTAC群で1.0±1.4 、MMF群で0.79±1.1 (p=0.31)。SDI scoreの増加は18ヶ月の時点で寛解しなかった患者においてそうでない患者と比べ有意に高かった (1.6±1.5 vs 0.7±1.1; p=0.009)。主に腎炎、神経精神のスコアによるものであった (data not shown)。糖尿病がTAC群で4例 (5.4%)、MMF群で2例 (2.6%) (p=0.44)。降圧剤で治療された患者は有意差はつかなかったがTAC群でMMF群よりも高かった(51% vs 37%; p=0.07).
Renal function deterioration and prognostic factors
MMFで治療された患者ではベースラインから≥30%のeGFR低下があった者が21%、CKD stage 4/5への伸展が18%、死亡が14%。これらの数字はTAC群 (24%, 19% and 12%) と比べ有意差はなかった (p = 0.63, 0.94 and 0.68).
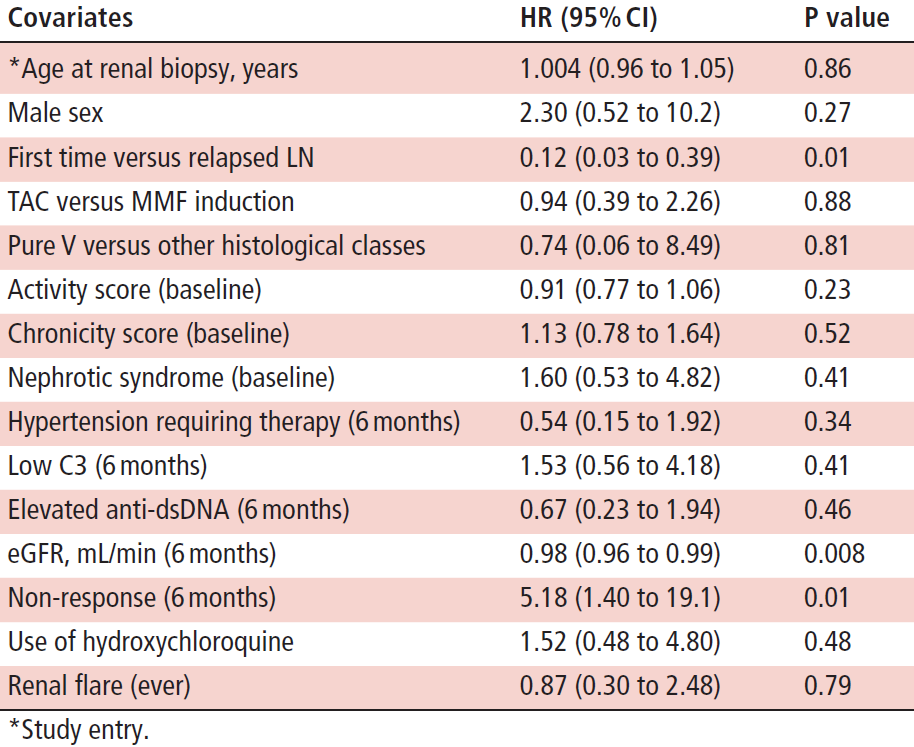
Figure 4はcomposite outcome(decline of eGFR by ≥30%, CKD stage 4/5 progression or deathで定義)の累積発生率がMMF群において5年で24%、10年で33% 、TAC群において5年で17%、10年で33% (p=0.90)であったことを示す。
Figure 4
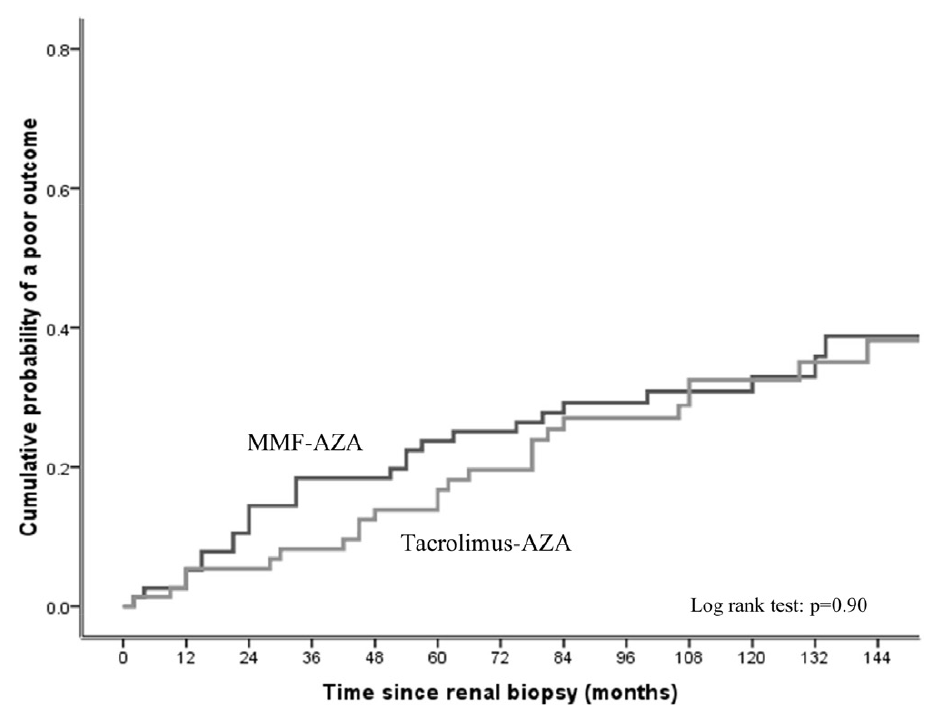
このcomposite outcomeに有意に関連した因子は初発時のLN (HR 0.12 (0.03 to 0.39); p=0.01)、eGFR (HR 0.98 (0.96 to 0.99); p=0.008)、6ヶ月の時点での腎炎の反応なし (HR 5.18 (1.40 to 19.1); p=0.01; table 2)。
Table 2. Factors independently associated with a poor clinical
outcome (≥30% drop in eGFR, CKD stage 4/5 development or death; Cox regression)
実験的ROC解析は18ヶ月後のeGFRのカットオフ値80 mL/min (AUC 0.70; sensitivity 0.64, specificity 0.66)、UPCR 0.75 (AUC 0.73; sensitivity 0.69, specificity 0.74)が最も良く、CKD stage 4/5または≥30%のeGFR↓を予測した(online supplementary table 3; figure 5)。
純粋な膜型LNの患者の長期的なアウトカムと6ヶ月後に再導入療法を要さなかった患者の長期的なアウトカムをonline supplementary figures 2 and 4(#略)に示す。TAC群とMMF群の間で差はなかった。
Supplementary Figure 2: Renal outcome at last visit (↓eGFR ≥30%, CKD 4/5 or death) in patients with pure membranous LN (N=28)
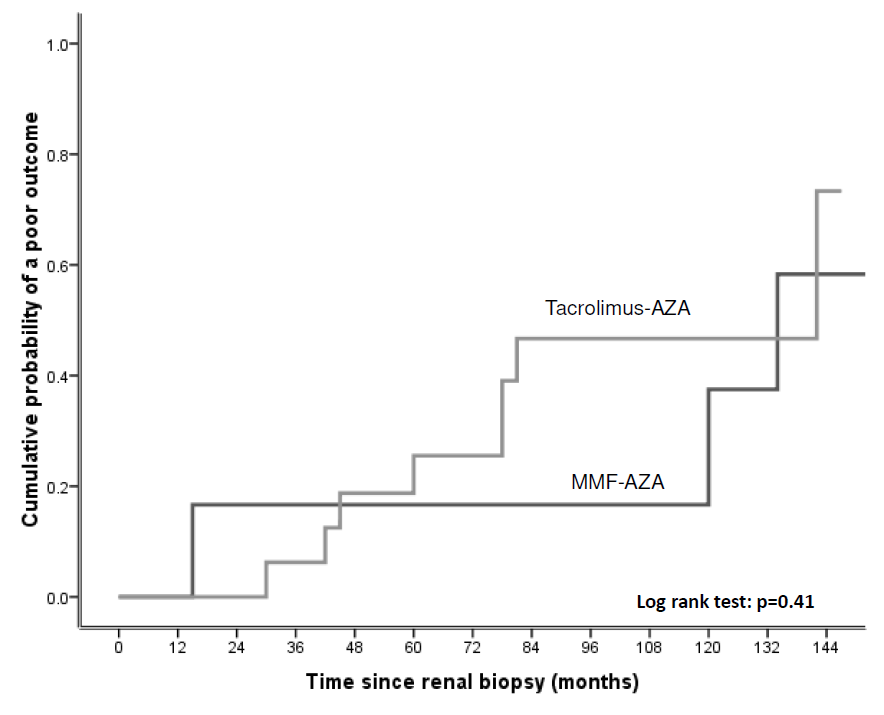
Figure 6はcomposite outcomeの累積発生率を18ヶ月後の腎炎の反応性に応じて示したもの。治療群に関わらず。10年時の腎予後不良の発生は18ヶ月後に反応しなかった者(NR)でその他のPRやCRの患者に比べて有意に高かった (HR 4.94 (2.72 to 8.97); p<0.001).
<リウマトロジストのコメント>
LNの寛解導入療法として、TAC vs MMFを比較した最初のRCTのextended reportです。10年という長期にわたって全例がフォローされており、TAC導入療法は標準治療のMMFと長期的にも同等であることが分かりました。今後のrecommendationsの改訂には引用される研究結果と思われます。
とくにV型(膜型)LNに対してはMMFが推奨されていますが、このRCTでalternative therapyとしてTACを考慮すべきと言ってもよいのではないかと思います。
残念なことに、この試験で用いられたTAC (0.06–0.1 mg/kg/day)とは、 初期量は0.1 mg/kg/dayを2分割で開始され、3ヶ月の時点で臨床的反応が良ければ0.06mg/kg/dayに減量されるという方法でした。つまり日本の上限が3㎎であることを考えると、残念ながら日本人に応用できるデータではないと思われます。
日本で生まれた薬なのに...公知申請でもしてせめて5mgまで使えるようにしてもらえないかなあ...
ps
↓SLEの緊急病態
↓執筆協力しております!