LNに対するObiのphase3、 REGENCY が発表されました。
Method
Entry Criteria
対象は18~75歳で、全身性エリテマトーデスのACR分類基準を満たし、スクリーニング中または6ヵ月以内の腎生検において活動性のLN IIIまたはIV(V合併の有無を問わない)を有することとされた。登録基準には、24時間採尿によるUPCRが1以上(蛋白とCrはともにmg単位で測定)、ANA陽性(HEp-2細胞でのANA力価が1:80以上、または同等のANA検査陽性が1回以上)が含まれた。主な除外基準は、eGFRが体表面積1.73m2あたり毎分30ml未満、または透析や移植が必要な末期腎臓病、活動性感染症の証拠、スクリーニング期間中または前9ヵ月以内に抗CD20療法を受けたこと、スクリーニング期間中または前2ヵ月以内にシクロホスファミド、タクロリムス、シクロスポリン、ボクロスポリン療法を受けたこと。
Trial Procedures
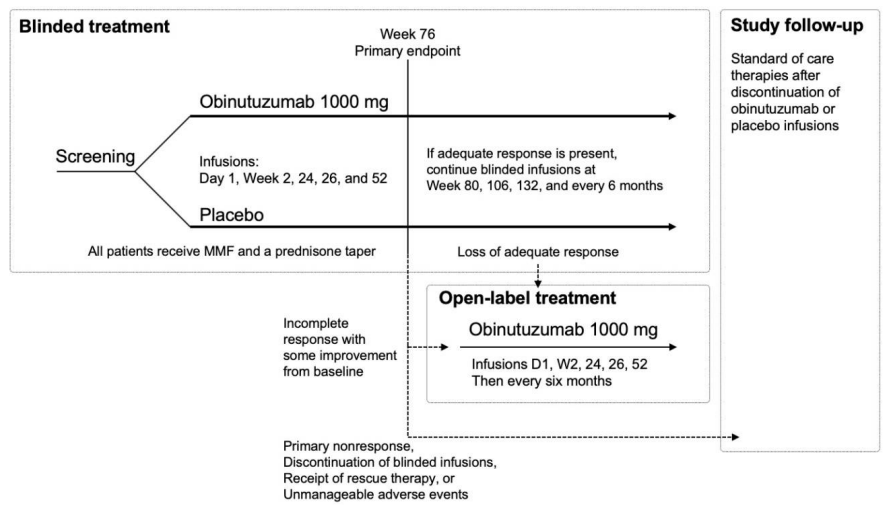
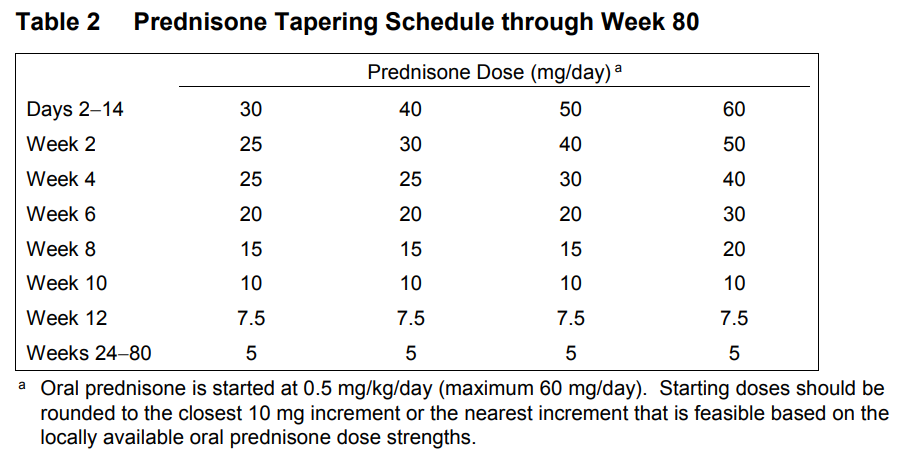
患者はオビヌツズマブまたはプラセボの静脈内投与を受ける群に1:1の割合で無作為に割り付けられた。無作為化は、中央集中型の音声およびウェブベースの応答システム(IxRS)を用いて、地域(米国またはカナダ、ラテンアメリカまたはカリブ海諸国、その他)および人種(黒人またはその他)によって層別化されたパーミュートブロックデザインを用いて行われた。オビヌツズマブ群に割り付けられた患者は、2つの投与スケジュール(初日および2週目、24週目、26週目、52週目に1000mgを投与し、50週目に追加投与する群としない群)のいずれかに再び1:1の割合で無作為に割り付けられた。2つの投与スケジュールを含む根拠は探索的であり、追加的な薬物動態学的および薬力学的データを収集し、長期治療(本試験の主要エンドポイントに使用された76週目以降)のための投与レジメンの選択に情報を提供するために、有効性における潜在的な用量関連の差を探索することを目的とした。両試験群の患者は、無作為化時にMMFとPSNによる標準治療を開始した(まだ受けていない場合)。PSNの目標用量は12週目までは1日7.5mg、24週目までは1日5mg。プロトコールで指定された治療法および経口PSN漸減スケジュールの詳細は、補足方法のセクションおよびTable S1に記載されている。
End Points
primary endpointは76週目の完全腎反応であり、24時間採尿によるUPCR<0.5であること、eGFRがベースライン値の85%以上であること(2009年CKD疫学共同研究式を用いて算出)、併用イベント(レスキュー療法、治療失敗、死亡、早期試験中止)が発生しないことと定義。治療失敗とは、末期腎臓病または長期透析もしくは腎移植の実施、レスキュー療法(GCのみのレスキュー療法を除く)の実施、または臨床的に有意かつ持続的なUPCRもしくはeGFRの24週目以降の悪化で、治験責任医師が割り付けられたレジメンが失敗したと判断したものと定義。
主なsecondary endpointは、64~76週目までのPSN≤7.5mgで、76週目の完全腎反応を達成する事、76週目におけるイベント併発のないUPCR≤0. 8の達成、ベースラインから76週目までの推定GFRの変化、76週目までの死亡または腎関連イベント、50週目における総合的な腎反応(完全腎反応または部分腎反応と定義)、ベースラインから76週目までのFunctional Assessment of Chronic Illness Therapy-Fatigue (FACIT-F)のスコアの変化(表S2)。部分腎反応とは、ベースラインからUPCRが50%以上減少したこと、UPCR<1(ベースラインのUPCRが3以上の場合は<3)であったこと、eGFRがベースライン値の85%以上であったこと、および併発事象がなかったこと。FACIT-Fは、患者が報告する疲労と、それが日常活動や機能に及ぼす影響を評価する13項目の尺度であり、スコアは0~52の範囲で、スコアが高いほど疲労が少ないことを示す。
Safety Assessments
安全性評価には、AEs、重篤なAEs、特記すべきAEs(see the Supplementary Methods section)、バイタルサイン、および臨床検査値の評価が含まれた。安全性解析は、盲検化された方法でオビヌツズマブまたはプラセボのいずれかの点滴を受けたすべての患者を含む安全性集団で行われた。安全性集団の患者は、無作為に割り付けられた試験群に関係なく、実際に投与された点滴に従ってグループ分けされた。独立したデータ・安全性モニタリング委員会が継続的な安全性レビューを行った。
Statistical Analysis
略
Results
Trial Population
2020年7月~2023年3月までに、合計513人の患者がスクリーニングを受け、271人がオビヌツズマブ投与群(135人)とプラセボ投与群(136人)に無作為に割り付けられた(図S2)。ベースライン特性は試験群間で概ね均衡していた(Table 1およびTable S4)。平均年齢(±SD)はオビヌツズマブ群で33.0±10.5歳、プラセボ群で32.7±10.0歳であり、各114例(84.4%)、115例(84.6%)が女性。登録された集団は、ループス腎炎の有病率が高く、合併症や死亡のリスクが高い集団(例えば、黒人またはアフリカ系アメリカ人、アジア人、ヒスパニックまたはラテン系の患者であり、患者が報告した人種または民族グループによると、それぞれ試験集団の14.8%[40人]、5.9%[16人]、57.6%[156人]を占めた)を含み、十分に多様であると考えられた。
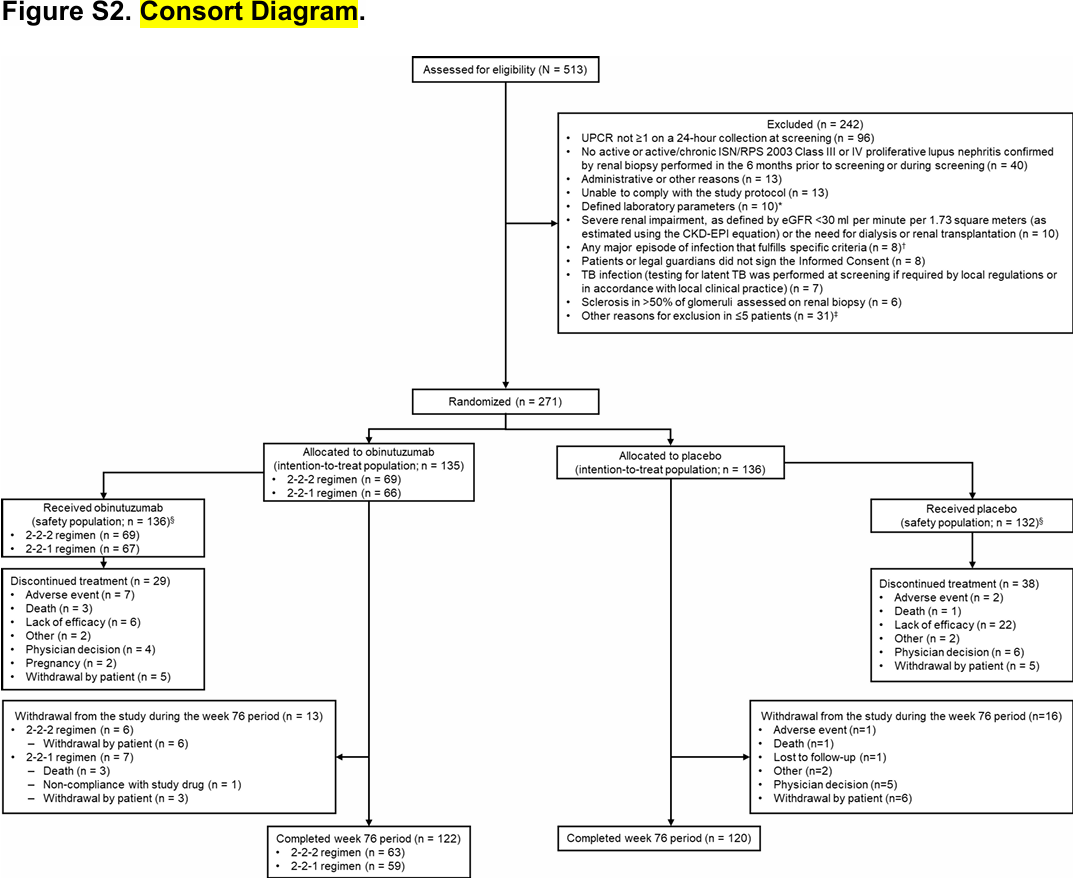
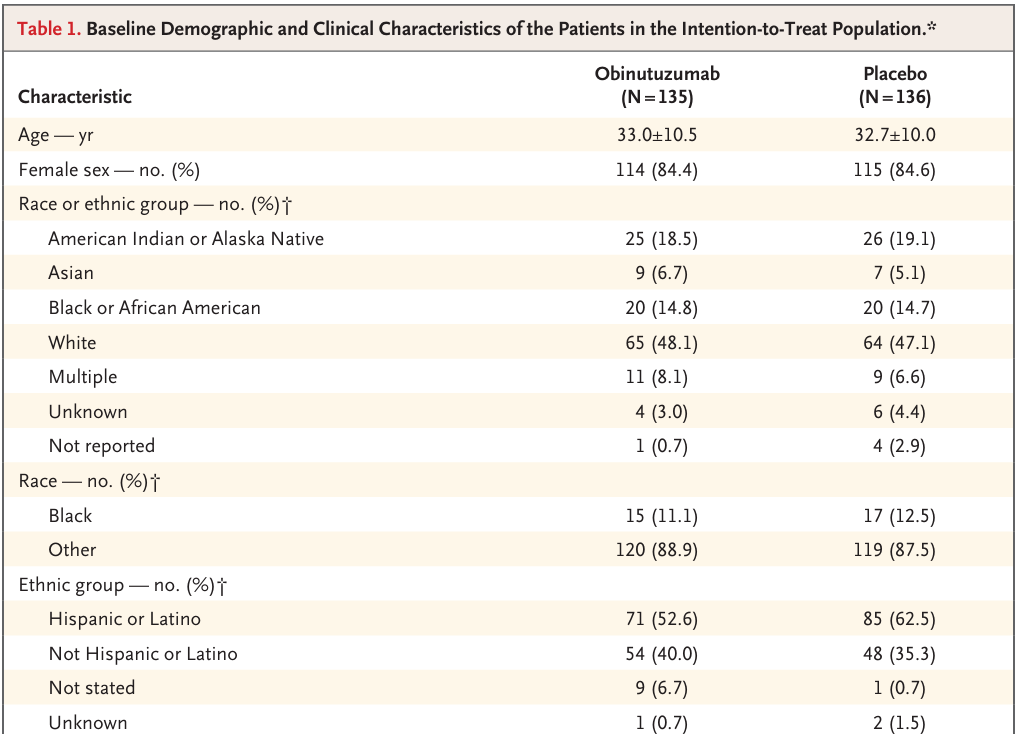
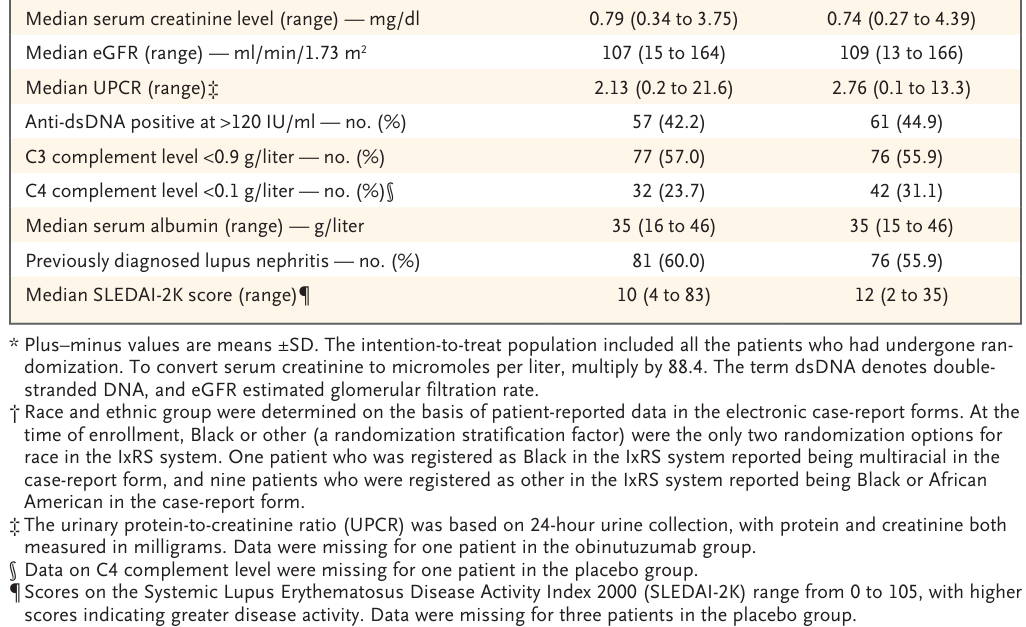
Table S4. baseline demographic and clinical characteristics of the patients in the ITT population
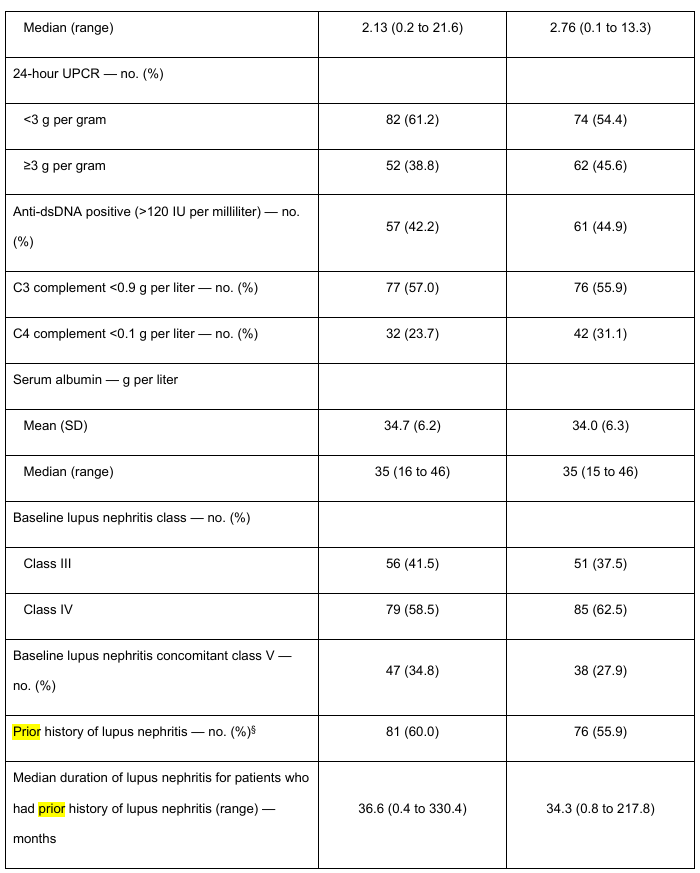
試験集団の代表性を表S3に示す。新たにループス腎炎と診断された患者とは対照的に、以前にループス腎炎と診断された患者(オビヌツズマブ群81例、プラセボ群76例)では、最初のループス腎炎診断からの期間中央値は、オビヌツズマブ群で36.6ヵ月(範囲、0.4〜330.4)、プラセボ群で34.3ヵ月(範囲、0.8〜217.8)であった。平均eGFRはオビヌツズマブ群102.8±29.3ml/分/1.73m2、プラセボ群101.9±32.2ml/分/1.73m2、平均UPCRはそれぞれ3.14±2.99、3.53±2.76であった。
Primary and Key Secondary End Points
week 76(primary endpoint)におけるCRRは、オビヌツズマブ群では46.4%、プラセボ群では33.1%に認められた(adusted difference, 13.4%ポイント;95%CI 2.0~24.8;P=0.02)(Table 2)。プラセボ群では、オビヌツズマブ群に比べ、intercurrent eventsの割合が数的に高かった(treatment failure 17.6% vs 3.7%;レスキュー治療17.6% vs 5.9%)(Table S5)。week 64~week 76の間にPSN≤7.5mgとなり、CRR@week 76の達成が認められたのは、オビヌツズマブ群では42.7%、プラセボ群では30.9%であった(adusted difference, 11.9%ポイント;95%CI0.6~23.2;P=0.04)。
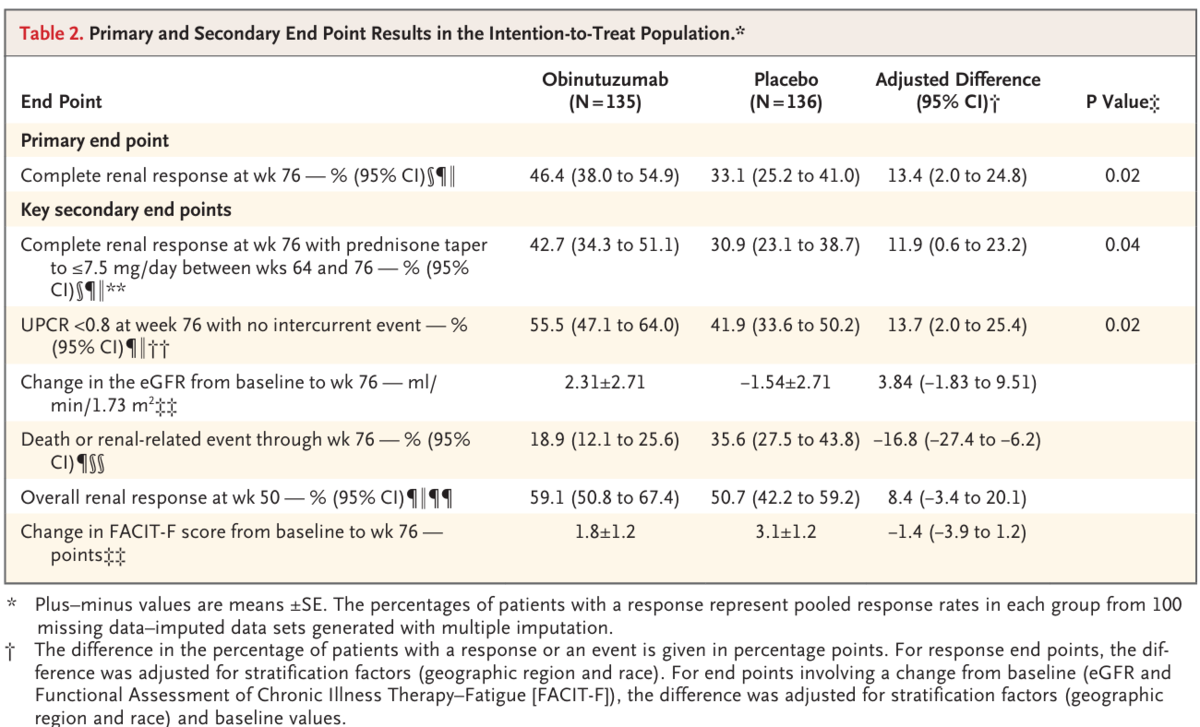

死亡を唯一の併発イベントとした一次エンドポイントの探索的解析の結果は、一次解析の結果と一致した(Table S6)。week 76のUPCR<0.8で、再発イベントのなかった患者の割合は、オビヌツズマブ群で55.5%、プラセボ群で41.9%であった(adjusted difference, 13.7%ポイント;95%CI 2.0~25.4;P=0.02)(Table 2)。調整後の平均(±SE)eGFRは、ベースラインからweek 76まで、オビヌツズマブ群では1.73m2あたり毎分2.31±2.71ml増加したが、プラセボ群では1.73m2あたり毎分1.54±2.71ml減少した(adjusted difference, 3.84ml/min/1.73m2;95%CI -1.83~9.51)。week 76までの死亡または腎関連イベントは、オビヌツズマブ群で18.9%、プラセボ群で35.6%に発生した(adjusted difference, -16.8%ポイント;95%CI -27.4~-6.2)。ベースラインからweek 76までのFACIT-Fスコアの調整後平均変化は、オビヌツズマブ群で1.8±1.2ポイント、プラセボ群で3.1±1.2ポイント(調整後差、-1.4ポイント;95%CI、-3.9~1.2)であり、この所見は、疲労の軽度の減少が両群で同程度に起こったことを示している。
Subgroup Analyses
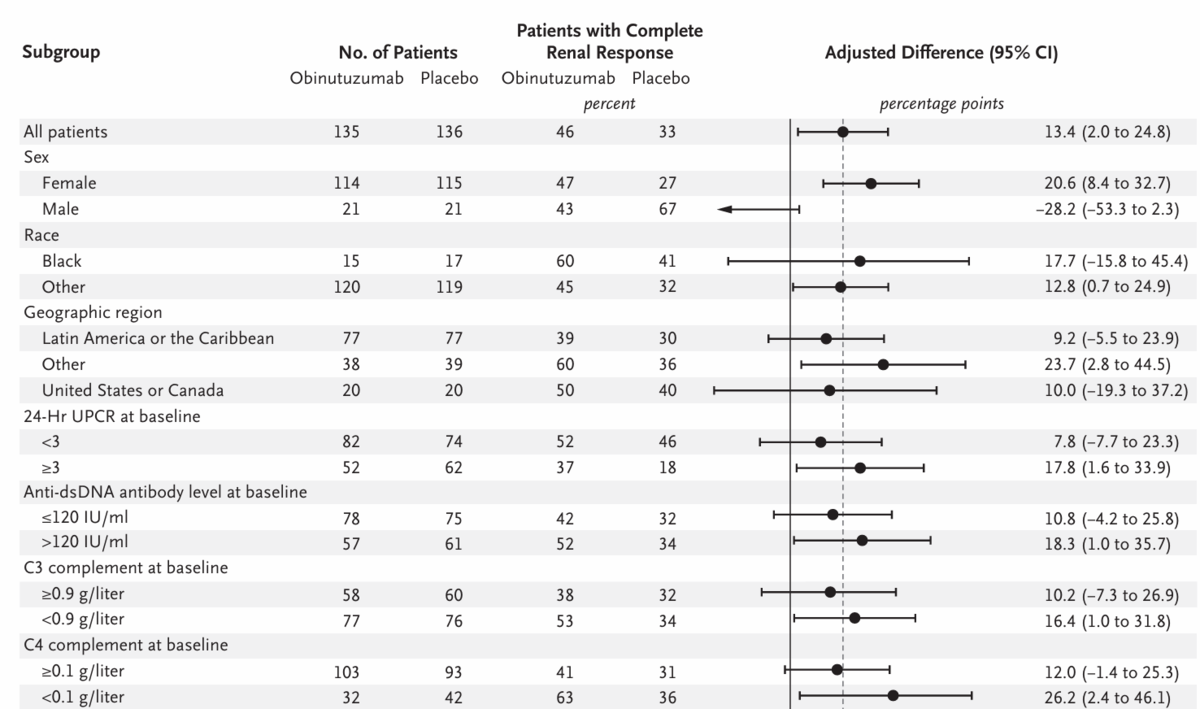
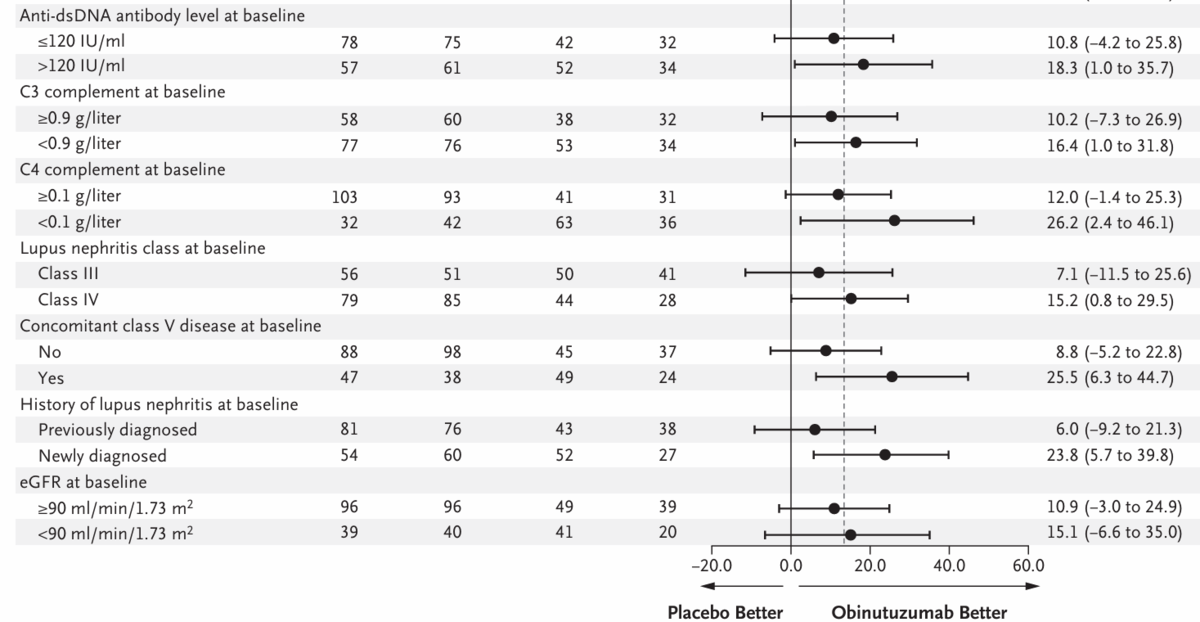
week 76のCRRに関する事前に規定されたサブグループ解析の結果は、クラスIVのループス腎炎患者、クラスVのループス腎炎を合併した患者、ベースライン時のUPCR≥3の患者、または血清学的活性(ベースライン時のC3またはC4補体レベルが低いか、二本鎖DNA[dsDNA]に対する抗体のレベルが高い)を有する患者を含むサブグループ間で概ね一貫していた(Figure 1)。プラセボ群で完全腎反応を示した男性の割合が高かったため(21人の比較的少数のサブグループで67%)、完全腎反応に関する効果量に男女間で差が認められた。76週目に完全腎反応を示した患者の割合は、2つのオビヌツズマブ投与スケジュール間で有意差はなかった(Table S7)。
Figure 1
Pharmacodynamics, Serologic Analysis, and Immunogenicity
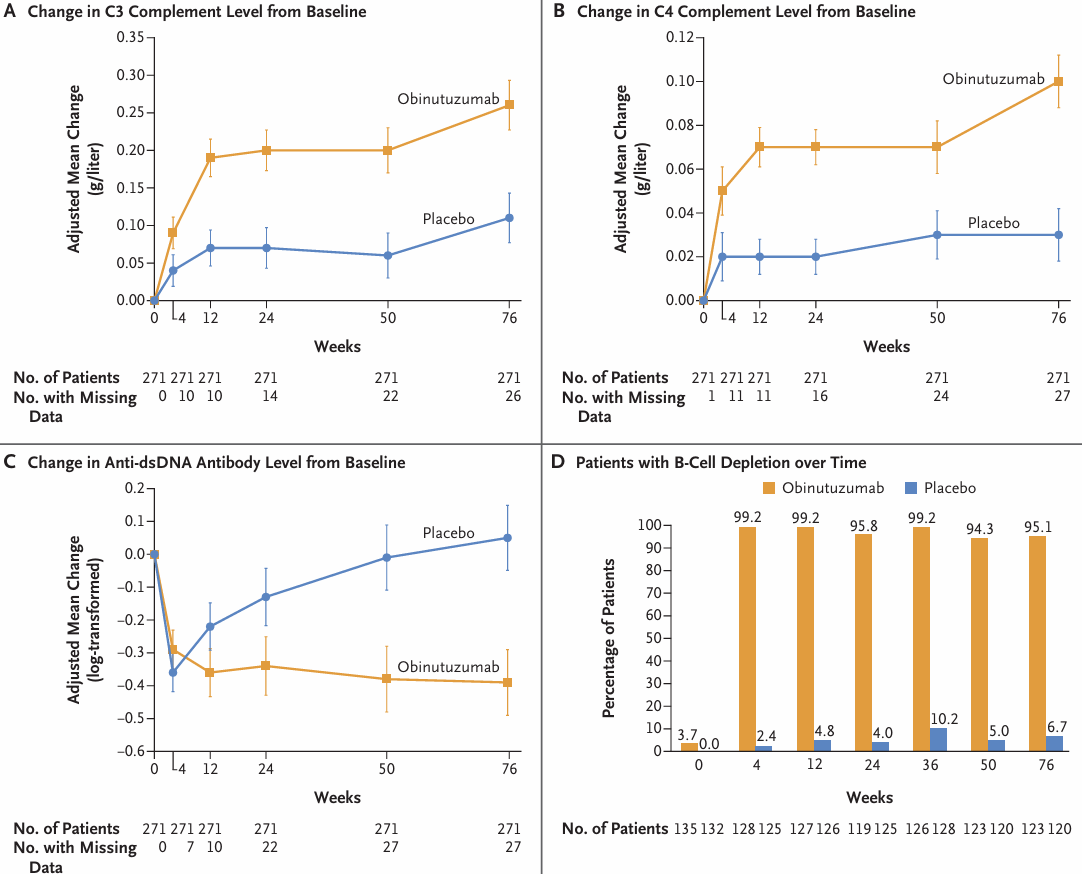
Figure 2. Serologic and Pharmacodynamic Analyses over Time
ベースラインからweek 76までのC3補体、C4補体、およびdsDNAに対する抗体のレベルの調整平均変化は、プラセボ群よりもオビヌツズマブ群で大きかった(Figure 2A、2B、2CおよびFigure S11)。末梢CD19陽性B細胞が完全に枯渇した患者の割合は、プラセボ群よりもオビヌツズマブ群で大きかった(Figure 2DおよびFigure S4)。IgGレベルの縦断的評価をFigure S5に示す。
Safety
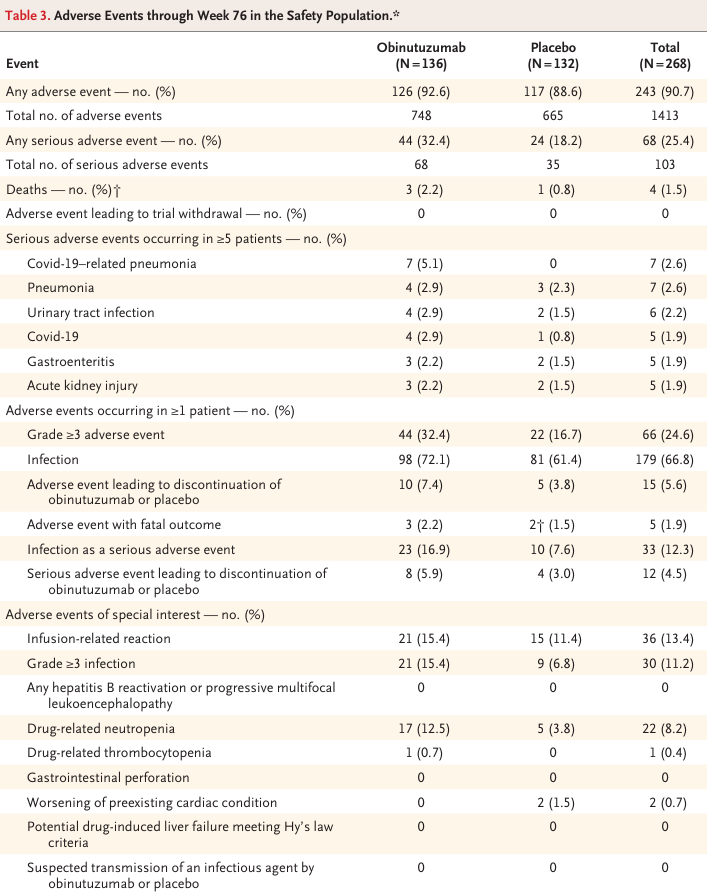
AEsが発生した患者の割合は、オビヌツズマブ群とプラセボ群で同程度であった(table 3)。重篤なAEsはオビヌツズマブ群では136例中44例(32.4%)、プラセボ群では132例中24例(18.2%)。オビヌツズマブ投与群で最も頻繁に認められた重篤なAEsは、Covid-19関連事象、尿路感染、肺炎、胃腸炎を含む感染症。確定または疑われるCovid-19関連事象を除外すると、重篤な感染症の発生率はオビヌツズマブ群で16.9%から11.0%に減少し、プラセボ群では変化なし(7.6%)であった(Table S8)。Covid-19に関連した重篤なイベントは試験の初期に発生した(Figure S3)。week 76の評価期間中に4人の患者が死亡した。オビヌツズマブ群で3人(COVID-19に関連した肺炎2人とネフローゼ症候群1人)、プラセボ群で1人(COVID-19による)であった(Table S9)。プロトコールで定義された特に注目すべきAEs(輸液関連反応、グレード3以上の感染症、薬剤関連好中球減少症)はプラセボ群よりオビヌツズマブ群でより多くの患者に発現した(Table 3)。体重減少の重篤な有害事象1件と死亡4件を除き、オビヌツズマブ投与群の重篤な有害事象はすべてwee 76までに消失、または消失していた。薬剤に関連した好中球減少事象はすべてweek 76までに消失または解消(Table S10)
Table 3.
Discussion
リツキシマブによるループス腎炎評価(LUNAR)試験では、リツキシマブを投与した場合、プラセボを投与した患者に比べ、CRRの割合の有意な増加は認められなかった14。NOBILITY試験は、より深いB細胞枯渇がCRR率を高めるかどうかを評価したもので、オビヌツズマブと標準治療を併用したループス腎炎患者は、標準治療のみを受けた患者よりもCRRの頻度が高いことが示された7。
第3相REGENCY試験でも同様の結果が確認された:オビヌツズマブと標準治療の併用は、プラセボと標準治療の併用よりも、CRRの割合を有意に増加させた。疾患活動性が高いことを示すベースラインの特徴(例えば、UPCR≥3の蛋白尿、C3またはC4補体値の低下、dsDNAに対する抗体の高値、クラスIVのループス腎炎、またはクラスVの疾患の併存)を有するサブグループでは、CRRを得た患者の割合のadjusted differenceがより大きかった。これらの所見はNOBILITY試験における所見と一致した16。
オビヌツズマブの糖鎖工学的II型抗CD20構成は、より大きな直接細胞死、Fcレセプターを介した抗体依存性細胞傷害性の増強、抗体依存性細胞貪食作用をもたらす5,6,17-19。末梢血におけるB細胞の排除の増加に加えて、オビヌツズマブ投与後、非ヒト霊長類およびヒトにおいて組織常在B細胞の高レベルの枯渇が示されている5,20,21。B細胞性悪性疾患患者において、オビヌツズマブはリツキシマブと比較して優れたB細胞枯渇をもたらし、慢性リンパ性白血病患者におけるオビヌツズマブの有効性はリツキシマブよりも優れていた20。さらに、キメラ抗原受容体T細胞療法の予備的結果は、ループス腎炎患者における深部B細胞枯渇の有用性の可能性を示唆している22-24。
今回の試験では、感染症を含む重篤なAEsの発生率および好中球減少症の発生率は、オビヌツズマブ投与群の方がプラセボ投与群よりも高かった。新しいタイプのAEsは観察されなかった。これらのリスクおよびオビヌツズマブのより広範な安全性プロファイルは、治療を開始するかどうかを決定する際に考慮されなければならない。感染性の重篤な有害事象に関連する不均衡は、部分的にはCovid-19に関連する事象に起因するようであったが、他の感染性の重篤な有害事象も観察された。Covid-19に関しては、今回の試験は世界保健機関(WHO)によるパンデミック宣言の4ヵ月後に登録が開始され、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染に関連する重篤な有害事象は、強固なワクチン接種と抗ウイルス療法が利用可能になる前のこの試験の早い時期に発生した。実際、Covid-19に関連した重篤な有害事象は、本試験の後半には発生していない。さらに、グローバル登録には、Covid-19に関連した感染や死亡の発生率が高い地域も含まれていた25。
Covid-19の大流行前に実施された第2相NOBILITY試験では、オビヌツズマブはプラセボよりも重篤な有害事象、重篤な感染症、死亡が少なかったが、オビヌツズマブ全体の用量は今回の第3相試験で使用された用量よりも少なかった7。ミコフェノール酸モフェチルと抗CD20療法を受けている患者では、SARS-CoV-2感染に対するワクチン接種を考慮すべきである26。抗CD20療法を受けている多発性硬化症患者では、ワクチン接種を受けていない患者よりも重症感染症の発生率が低かった27。また、オビヌツズマブ治療を受けた濾胞性リンパ腫患者では、ワクチン接種によりCovid-19に関連した有害転帰が軽減された28。したがって、全身性エリテマトーデス患者において適切なワクチン接種を行うことにより、オビヌツズマブ治療による感染症関連の有害転帰の発生率がおそらく低下すると考えられる。ミコフェノール酸モフェチルはCovid-19ワクチン接種に対する体液性応答と細胞性応答の両方を低下させる29。一方、抗CD20療法によるB細胞枯渇は主に抗体応答を減弱させ、血液学的悪性疾患30や多発性硬化症患者ではT細胞介在性応答がそのまま残る31。それにもかかわらず、ミコフェノール酸モフェチル療法にオビヌツズマブを追加した場合、今回の試験ではCovid-19のリスク上昇と関連しており、このリスクを考慮して治療を決定する必要がある。
プラセボを投与され、CRRの割合は、女性よりも男性の方が約40%ポイント高かった。この差は、この試験に参加した男性の数が比較的少なかったためと思われる。NOBILITY試験でeGFRの有意な減衰が認められたのとは対照的に、今回の試験ではベースラインからweek 76までのeGFRの減衰は有意ではなかった。104週目のeGFRエンドポイントに関する所見はまだ得られていない。
オビヌツズマブ投与群はプラセボ投与群に比べ、感染症(主に呼吸器感染症)の発症率が高かった。オビヌツズマブ投与群では、プラセボ投与群に比べ、プレドニゾンの1日投与量が少なくてもweek 76に腎機能が完全に改善する可能性が高かった。32-39。これらの所見とNOBILITY試験の所見は、オビヌツズマブによる深部B細胞枯渇がループス腎炎患者に対する有効な治療法であるという仮説を支持するものである。
生検で証明された活動性ループス腎炎の成人を対象としたこの試験では、オビヌツズマブを標準療法に追加することで、week 76にCRRの割合が、標準療法単独よりも有意に増加した。
<リウマトロジストのコメント>
Obinutuzumabを投与されたLNの6割がLNの歴ありで、3年の病歴がありました。登録時にUPCR≥1が必要であったので、ある程度前治療に抵抗性を示していた事がうかがえます。その治療内容は与えられておりませんが、MMFであったケースが多かったのではないかと予測します。6割のLN歴のある患者のうち多くがMMFの前治療を受けていたであろう集団で、OBIに当たればよいのですが、Placeboに当たった場合は無効と分かっているMMFを再度投与されるというデザインになっており、本当のStandard of care(SoC)に対してOBIの有効性はまだ示されていないのではないか、、、とAURORA-1と似たデザインであることに懸念を持ちました。
しかし、結果を見る限り、 プラセボ群の反応率は33.1%とRTXのLUNAR研究の31%に及ぶ反応率でありました。したがって、どうしてそんなに高い率になったのかは分かりませんが、SoCの成績は良好であった・・・そんなプラセボ群に対してOBIの優越性が検証されました。しかも、サブグループ解析を見る限り、BLISS-LNとは正反対の結果が示されています。つまりBLISS-LNでは再発例で効果が高く、初発例では傾向しか示せなかったのですが、REGENCYでは再発例では傾向にとどまり、初発例で有意差を示しました。またBLISS-LNではUPCR≥3gでは全くきかず、<3gで大きな効果が示されました(ARR=21%)。REGENCYでは<3gで有意差つかず、むしろUPCR≥3で有意差がついたのです(Figure 2)。
BLISS-LNのサブグループ解析 - リウマチ膠原病のQ&A
数年後にはBelimumabとの使い分けがトピックとなっているでしょう。3-4型LNの治療として、UPCR≥3ならObinutuzumab、<3ならBelimumabが妥当と考えられてよいでしょう。